《自然·医学》:预测“T+A方案”治疗晚期肝癌疗效的标志物,找到了!
来源:奇点糕 2022-08-05 11:32
贝伐珠单抗提升阿替利珠单抗的抗肿瘤作用的可能原因:抑制VEGF介导的肿瘤血管新生,改善髓系免疫和抑制Treg细胞增殖。
2007年11月,美国食品药品监督管理局(FDA)批准索拉非尼用于治疗不可切除的肝细胞癌,彻底打破了晚期肝癌无药可用的局面。
PD-L1抑制剂阿替利珠单抗联合VEGF抑制剂贝伐珠单抗的靶免联合治疗方案(简称T+A方案)的出现,撼动了索拉非尼的地位。
根据我国原发性肝癌诊疗指南(2022年版)[1],T+A方案与索拉非尼均列为晚期肝癌一线治疗方案。而美国NCCN肝胆癌诊疗指南(2021年版)[2],T+A方案不仅与索拉非尼均列为晚期肝癌一线治疗方案,更是成为唯一的一线治疗优选方案。
以“T+A方案”为代表的靶向+免疫等联合治疗方案,虽然极大地丰富了我们对抗肝癌的“武器库”;但是,联合治疗方案的肝癌受益人群仍较少,寻找疗效相关的标志物迫在眉睫。
近日,由基因泰克的Yulei Wang领衔的研究团队,在著名期刊《自然·医学》发表的最新研究[3],为这个问题带来了新的答案。
研究人员发现相较于索拉非尼单药,肿瘤中预先存在的免疫成分(CD274分子,T细胞效应相关标记和CD8+T细胞密度)高的肝癌患者往往更能从T+A方案中获益;而调节性T细胞(Treg)/效应T细胞(Teff)比例高和癌胚基因(GPC3和AFP)表达高的肝癌患者往往T+A方案疗效较差。
此外,相较于阿替利珠单抗单药,肿瘤中VEGFR2、Tregs和髓系炎症相关标志物高表达的患者,采用T+A方案获益更好。

论文首页截图
在故事正式讲述之前,有必要进行一些前情回顾。
2020年6月,《柳叶刀·肿瘤学》报道了代号为GO30140的临床研究中A组和F组不可手术切除的肝细胞肝癌(HCC)患者治疗的最新数据[4]。GO30140是一项基于国际的多中心、开放标签的Ⅰb期临床试验,观察了T+A方案在不同实体肿瘤中的安全性和临床有效性。
这次公布的A组队列共入组患者104例,均采用T+A治疗方案。数据表明T+A方案在晚期肝癌一线治疗中客观缓解率(ORR)为36%。F组队列共入组患者119例,其中60例采用T+A方案,59例采用阿替利珠单抗单药治疗。数据表明T+A方案和阿替利珠单抗单药治疗的晚期肝癌患者中位无进展生存期(mPFS)分别是5.6个月和3.4个月(HR=0.55, 80% CI 0.40-0.74, P=0.011)。在安全性方面,除阿替利珠单抗和贝伐珠单抗单药治疗相关安全性事件外,没有发现与联合治疗相关的新的安全性问题。
同年《新英格兰医学期刊》报道了IMbrave150研究结果,这项研究推动了T+A方案成为晚期肝癌一线治疗新方案[5]。IMbrave150研究是一项开放标签、随机、平行对照的国际多中心Ⅲ期临床研究,共纳入501例既往未接受过系统治疗的不可切除的HCC患者,按照2:1的比例随机接受T+A方案或者索拉非尼单药治疗。
该研究的共同主要终点为独立审查机构根据RECIST 1.1版评估的总生存期(OS)和无进展生存期(PFS)。数据表明T+A方案的中位总生存期(mOS)尚未达到,索拉非尼组mOS为13.2个月,T+A方案可使OS风险降低42%(HR=0.58, 95% CI 0.42-0.79, P<0.001)。T+A方案的mPFS为6.8个月,优于索拉非尼组的4.3个月,疾病进展风险降低41%(HR=0.59, 95% CI 0.47-0.76, P<0.001)。
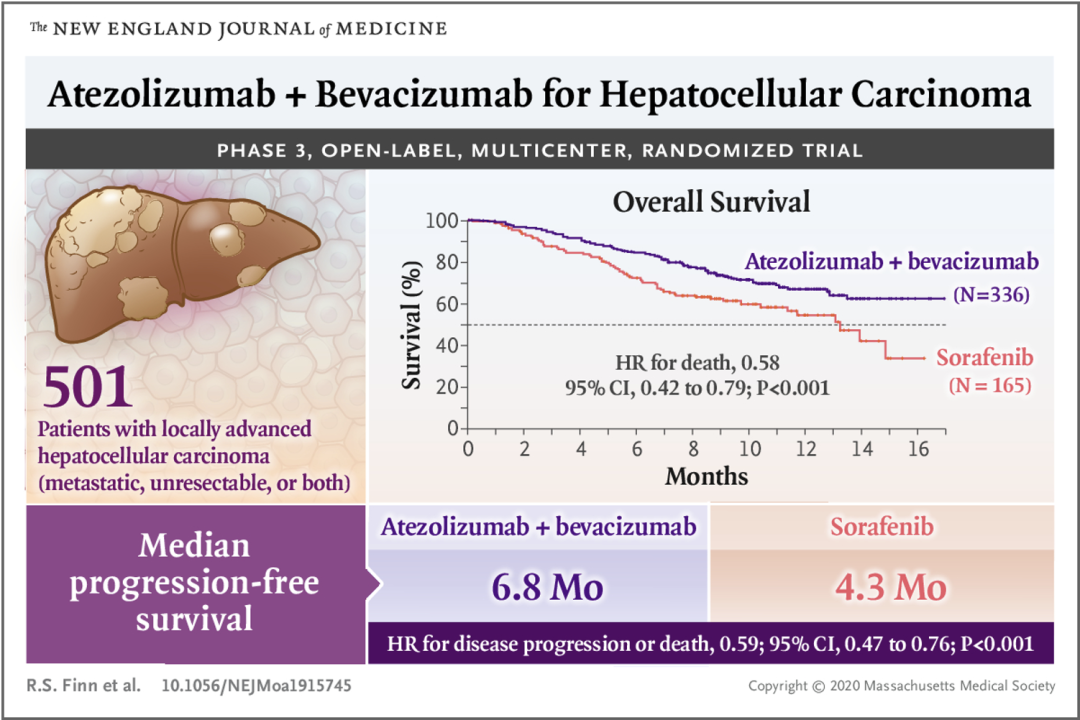
《新英格兰医学期刊》报道IMbrave150的重要研究结果,在当年传播甚广
最新公开的数据显示T+A方案的mOS为19.2个月,索拉非尼组的mOS为13.4个月,T+A方案可使OS风险降低34%(HR=0.66, 95% CI 0.52-0.85, P<0.001)。T+A方案的mPFS为6.9个月,优于索拉非尼组的4.3个月,疾病进展风险降低35%(HR=0.65, 95% CI 0.53-0.81, P<0.001)[6]。
作为GO30140和IMbrave150的重要参与者,Yulei Wang等对这两项研究的患者进行病理分析,来尝试解决如下两个问题。
第一个问题是寻找对T+A方案响应或抵抗的相关标志物。
研究人员以GO30140项目的A组队列(病例数n=90,下同)作为初始发现队列,再通过IMbrave150项目队列(n=177)做进一步确认和探索。大家如果留意的话,这些患者并不是两项临床试验的全部患者(ITT),而是其中的一部分患者,即文中所说的标志物可评估的患者(BEP)。需要说明的是,BEP和ITT患者的基线特征是一致的。
研究人员首先对GO30140项目的A组患者进行全基因组差异表达基因分析(DEG)和基因集富集分析(GSEA),发现T+A方案响应的患者显著富集抗肿瘤免疫反应相关的分子通路,包括IFNα/γ通路等。而治疗抵抗的患者显著富集血管生成、胆固醇稳态、胆汁酸代谢和Notch信号通路基因。
接着,研究人员利用xCell进行免疫浸润分析,发现CD8+和CD4+T细胞、Tregs、B细胞、DC均和治疗响应相关。在IMbrave150项目队列中,研究人员也得到了和前面类似的结果。
于是,研究人员利用DEG分析得到的差异最显著的10个基因构建了T+A方案响应相关的基因特征(简称ABRS)。无论是ABRS,或是CD274、Teff基因特征(CXCL9,PRF1和GZMB)均高表达于治疗响应的患者。
在IMbrave150项目队列中,这三个标志物高表达的患者使用T+A方案相较于索拉非尼单药治疗PFS和OS明显改善。但是,如果是低表达的患者,两种治疗方案的PFS和OS并无显著差异。
前面都是转录组层面的分析,研究人员进一步从组织原位进行验证。
他们设计了2组多重组化来探究肿瘤微环境的特征和临床疗效的关系。第1组是用来检测肿瘤-免疫-基质环境特征:HepPar 1/Arginase 1、FAP、CD31、CD8、MHC-I。第2组是用来表征T细胞的功能状态:HepPar 1/Arginase 1、CD3、PD-1、PD-L1、GZMB。
研究人员对GO30140项目的A组肿瘤样本(n=61)进行多重组化分析,与基因组层面发现一致,T+A方案响应的患者往往浸润更多的CD8+T细胞、CD3+T细胞、GZMB+CD3+T细胞和MHC-I+肿瘤细胞。
同时,他们也分析了IMbrave150项目的肿瘤样本(n=177),发现CD8+T细胞密度高的患者使用T+A方案相较于索拉非尼单药治疗PFS和OS明显改善。但是,如果是CD8+T细胞密度低的患者,两种治疗方案的PFS和OS并无显著差异。
至此,咱们看到了相较于索拉非尼单药治疗,更能受益于T+A方案的患者的特征:CD274分子和T细胞效应相关标记高表达,及CD8+T细胞高浸润。
咱接着看T+A方案抵抗的患者的特征。研究人员通过GSEA和xCell分析IMbrave150项目的肿瘤样本(n=177)转录组数据,发现Treg/Teff 基因特征比例低的患者使用T+A方案相较于索拉非尼单药治疗PFS和OS明显改善。
此外,研究人员还分析了HCC特异的肿瘤标志物AFP和GPC3与T+A方案疗效的关系。对于AFP或GPC3高表达的患者,两种治疗方案的PFS并无显著差异,但T+A方案的OS仍有改善的趋势。而AFP或GPC3低表达的患者使用T+A方案相较于索拉非尼单药治疗PFS和OS明显改善。
因此,概括来看使用T+A方案并不能优于索拉非尼单药治疗的患者特征是:Treg/Teff比例高、GPC3和AFP表达高。
第二个问题是探究T+A方案优于阿替利珠单抗单药治疗疗效的原因,换一个角度来看,这是想说明贝伐珠单抗如何提升阿替利珠单抗的抗肿瘤作用。
研究人员分析了GO30140项目的F组患者(其中T+A方案44例,阿替利珠单抗单药治疗47例)的转录组数据。DEG和GSEA分析均未发现疗效相关的基因或通路,xCell分析发现CD8+T细胞、Treg细胞和巨噬细胞等免疫类群与T+A方案临床获益有关。他们进一步发现Teff、Treg和髓系炎症相关的基因特征表达高的患者,使用T+A方案相较于阿替利珠单抗单药治疗PFS明显改善。
由于贝伐珠单抗靶向VEGF-VEGFR2(KDR)信号轴,研究人员分析了这两个分子和临床预后的关系,发现KDR高表达的患者更受益于T+A方案,这提示anti-VEGF可能通过抑制肿瘤血管新生来增强anti-PD-L1的疗效。
研究人员还通过CD31染色分析了F组患者的血管密度,他们发现血管密度高的患者使用T+A方案相较于阿替利珠单抗单药治疗PFS明显改善。这和anti-VEGF可以促进血管正常化和抑制肿瘤血管新生的机制是一致的。
为了验证这个机制假设,研究人员分析了14例肝癌患者治疗前后KDR和Treg基因特征的表达水平。
他们发现T+A方案响应或不响应的患者的KDR表达治疗后均下降。至于Treg基因特征,T+A方案响应的5例患者中有4例治疗后下降,而不响应的6例患者中只有2例下降。髓系炎症相关的基因特征在治疗前后并无一致的变化趋势。
为了深入理解贝伐珠单抗提升阿替利珠单抗的抗肿瘤作用的机制,研究人员利用了一个anti-PD-1治疗抵抗的小鼠HCC模型(MYC过表达,β-catenin活化)。类似地,他们也发现T+A方案相较于阿替利珠单抗单药治疗小鼠生存明显改善。
研究人员进一步分析了小鼠治疗后的免疫组成,发现T+A方案相较于阿替利珠单抗单药治疗小鼠,肿瘤浸润的总的和增殖的Treg数目有减少的趋势,并且增殖的Treg占总的Treg的比例减少。另外,研究人员还发现联合治疗组的单核细胞来源的巨噬细胞有减少的趋势。
结合临床样本和小鼠模型,咱们可以看到贝伐珠单抗提升阿替利珠单抗的抗肿瘤作用的可能原因:抑制VEGF介导的肿瘤血管新生,改善髓系免疫和抑制Treg细胞增殖。
总的来说,这项研究起点高——基于两项大型临床试验的患者样本。方法多——基因组转录组分析、原位蛋白水平检测、小鼠模型探究。意义大——相较于索拉非尼单药,CD274分子、T细胞效应相关分子和CD8+T细胞密度高的肝癌患者往往更加受益于T+A方案,而Treg/Teff比例高和癌胚基因(GPC3和AFP)表达高的肝癌患者往往T+A方案疗效较差。相较于阿替利珠单抗单药,肿瘤中VEGFR2、Tregs和髓系炎症相关标志物高表达的患者采用T+A方案获益更好。
肿瘤治疗已进入免疫+时代,随着二联三联等多种治疗组合兴起,临床实践已走在基础研究之前。临床样本和病案资料的分析总结,将有助于我们寻找更特异更实用的疗效相关分子标志物,也将反向推动基础研究更好地服务于临床。
参考文献:
[1].原发性肝癌诊疗指南(2022年版)[J].肿瘤综合治疗电子杂志,2022,8(02):16-53.
[2].Benson AB, D'Angelica MI, Abbott DE, Anaya DA, Anders R, Are C, Bachini M, Borad M, Brown D, Burgoyne A, Chahal P, Chang DT, Cloyd J, Covey AM, Glazer ES, Goyal L, Hawkins WG, Iyer R, Jacob R, Kelley RK, Kim R, Levine M, Palta M, Park JO, Raman S, Reddy S, Sahai V, Schefter T, Singh G, Stein S, Vauthey JN, Venook AP, Yopp A, McMillian NR, Hochstetler C, Darlow SD. Hepatobiliary Cancers, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2021 May 1;19(5):541-565. doi: 10.6004/jnccn.2021.0022. PMID: 34030131.
[3].Zhu AX, Abbas AR, de Galarreta MR, Guan Y, Lu S, Koeppen H, Zhang W, Hsu CH, He AR, Ryoo BY, Yau T, Kaseb AO, Burgoyne AM, Dayyani F, Spahn J, Verret W, Finn RS, Toh HC, Lujambio A, Wang Y. Molecular correlates of clinical response and resistance to atezolizumab in combination with bevacizumab in advanced hepatocellular carcinoma. Nat Med. 2022 Jun 23. doi: 10.1038/s41591-022-01868-2. Epub ahead of print. PMID: 35739268.
[4].Lee MS, Ryoo BY, Hsu CH, Numata K, Stein S, Verret W, Hack SP, Spahn J, Liu B, Abdullah H, Wang Y, He AR, Lee KH; GO30140 investigators. Atezolizumab with or without bevacizumab in unresectable hepatocellular carcinoma (GO30140): an open-label, multicentre, phase 1b study. Lancet Oncol. 2020 Jun;21(6):808-820. doi: 10.1016/S1470-2045(20)30156-X. Erratum in: Lancet Oncol. 2020 Jul;21(7):e341. PMID: 32502443.
[5].Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Kudo M, Breder V, Merle P, Kaseb AO, Li D, Verret W, Xu DZ, Hernandez S, Liu J, Huang C, Mulla S, Wang Y, Lim HY, Zhu AX, Cheng AL; IMbrave150 Investigators. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14;382(20):1894-1905. doi: 10.1056/NEJMoa1915745. PMID: 32402160.
[6].Cheng AL, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Lim HY, Kudo M, Breder V, Merle P, Kaseb AO, Li D, Verret W, Ma N, Nicholas A, Wang Y, Li L, Zhu AX, Finn RS. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol. 2022 Apr;76(4):862-873. doi: 10.1016/j.jhep.2021.11.030. Epub 2021 Dec 11. PMID: 34902530.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


