《癌细胞》:改写指南?基于NGS的错配修复缺陷检测相比标准方法,能够识别更多的免疫治疗获益乳腺癌患者
来源:奇点糕 2024-01-04 10:32
近日,美国布列根和妇女医院的Amin H. Nassar及其同事们发表在《癌细胞》期刊上的论文[1],揪出了当前指南中MMR标准检测方法的漏洞,并提供了能够帮助更多乳腺癌患者从免疫治疗中获益的方法。
近日,美国布列根和妇女医院的Amin H. Nassar及其同事们发表在《癌细胞》期刊上的论文[1],揪出了当前指南中MMR标准检测方法的漏洞,并提供了能够帮助更多乳腺癌患者从免疫治疗中获益的方法。
他们结合下一代测序技术(NGS)的检测结果发现,采用当前推荐的免疫组化染色(IHC)方法检测MMR-D时,有5.9%的子宫内膜癌患者和1%的结直肠癌患者被漏诊,而NGS可以识别出这些患者并帮助其接受更为有效的免疫治疗。
据估计,如果采用NGS进行MMR检测,可额外识别出5000多名被IHC漏诊的美国结直肠癌或子宫内膜癌患者。
这项研究结果支持重新评估指南中以IHC作为MMR标准检测方法的建议,并提出采用更加灵敏的NGS在诊断早期阶段进行MMR检测。

论文首页截图
DNA错配修复系统(MMR)在细胞中负责识别和修复DNA复制过程中产生的错误,维持遗传稳定性。当发生错配修复缺陷(MMR-D)时,常常引起DNA中的短串联重复序列长度改变,即微卫星不稳定性(MSI),并且与多种癌症的发展有关,特别是与结直肠癌和子宫内膜癌的关系最为密切。
MMR的常用检测方法为两种,一种是通过免疫组化染色(IHC)检测肿瘤组织中MMR蛋白(MLH1、MSH2、MSH6、PMS2)的异常表达,另一种是通过聚合酶链反应(PCR)检测MSI。目前,美国病理学会(CAP)、美国临床肿瘤协会(ASCO)、欧洲肿瘤医学学会(ESMO)推荐,将IHC作为结直肠癌或子宫内膜癌患者进行MMR检测的首选方法[2,3]。
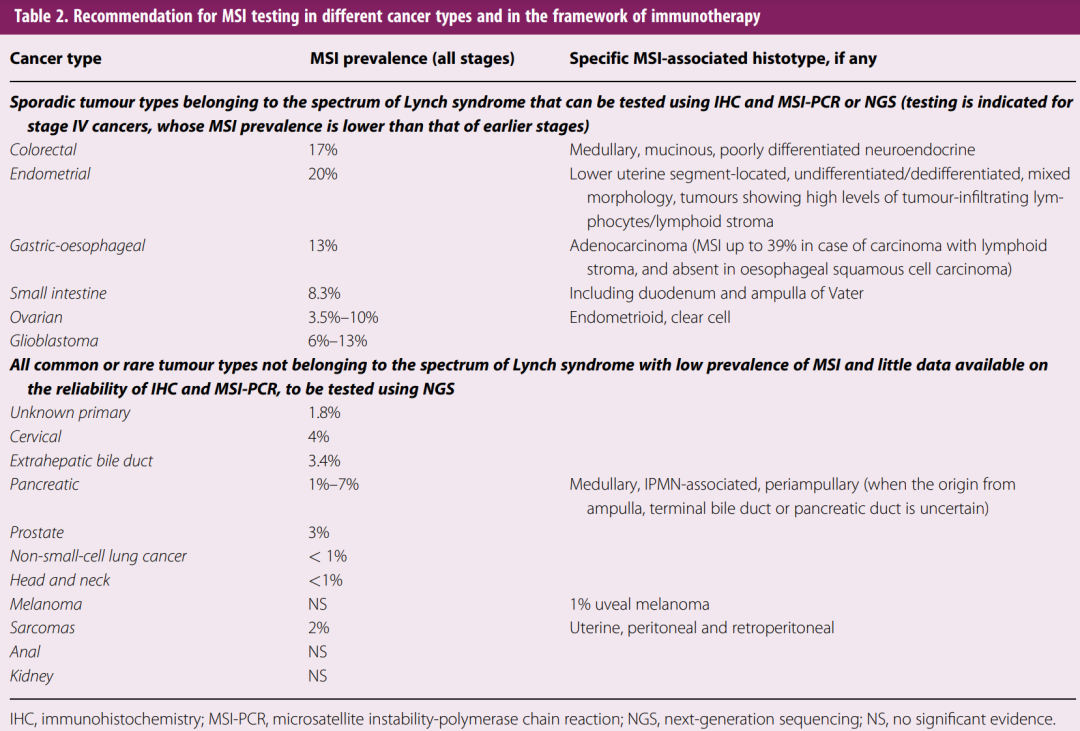
ESMO推荐在不同癌症类型和免疫治疗疗程中进行MSI检测[3]
下一代测序(NGS)又称高通量测序技术,能够快速、全面地检测和分析MMR-D所导致的MSI。此次研究共纳入1655名结直肠癌或子宫内膜癌患者,这些患者的MMR状态由IHC和NGS进行检测。
对比两种方式,Amin H. Nassar等人发现,5.9%的子宫内膜癌患者和1%的结直肠癌患者,其IHC的检测结果为错配修复功能正常,而NGS检测结果为MMR-D。
进一步分析结果显示,这些被IHC漏诊、而被NGS检测为MMR-D的患者,对免疫治疗的反应比其它全身治疗明显更好,具有更长的生存期。
另外,与NGS和IHC结果一致为错配修复功能正常的患者相比,这些患者接受免疫检查点治疗的中位总生存期和治疗失败时间显著延长(中位OS:NR[95%CI 10个月-NR] vs 14.9个月[95%CI 7.3-25],p=0.003)(中位TTF:44.4个月[95%CI 10-NR] vs 5.0个月[95%CI 3.2-7.3],p=0.001),而与NGS、IHC检测结果一致为MMR-D的患者免疫检查点抑制剂疗效相近。
这意味着,NGS可以更灵敏地检测MMR状态,并使具有MMR-D的结直肠癌患者或子宫内膜癌者不会错过对其更为有效的免疫治疗。
据统计,2022年美国新发结直肠癌和新发子宫内膜癌分别达到151030例和65950例。按此推断,仅以IHC作为检测方法,其中共有5401名具有MMR-D的患者被漏诊,而NGS检测可以识破IHC的假阴性结果。
“我们不想错过这些患者,否则可能会剥夺他们获得长期治疗益处的机会,”Amin H. Nassar表示[4]。“此外,我们也希望能够为不同患者提供适合的治疗方式,避开毒性更大或效果较差的疗法。”
随着NGS技术已经越来越多地被用于日常临床护理中,研究者们建议在诊断早期阶段采用NGS进行MMR检测,以及早识别漏诊的MMR-D患者,指导其采取适当的临床决策。接下来,他们将在更大队列中验证这一结论,并探索基于NGS的MMR检测方法是否同样有助于指导其它癌症类型患者的治疗。
参考文献:
[1]https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00420-8
[2]Vikas, P., Messersmith, H., Compton, C.,Sholl, L., Broaddus, R.R., Davis, A., EstevezDiz, M., Garje, R., Konstantinopoulos, P.A.,Leiser, A., et al. (2023). Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: ASCO Endorsement of College of American Pathologists Guideline. J. Clin. Oncol. 41, 1943–1948.
[3]Luchini, C., Bibeau, F., Ligtenberg, M.J.L., Singh, N., Nottegar, A., Bosse, T., Miller, R., Riaz, N., Douillard, J.Y., Andre, F., and Scarpa, A. (2019). ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann. Oncol. 30, 1232–1243.
[4]https://www.brighamandwomens.org/about-bwh/newsroom/press-releases-detail?id=4618
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


