Cell子刊:胥春龙团队等改造IscB-ωRNA基因编辑系统,通过单个AAV递送治疗遗传病
来源:生物世界 2024-11-22 09:48
该研究成功地通过工程改造转座子相关的CRISPR祖先系统:IscB-ωRNA系统,提高了IscB-ωRNA的基因敲除和碱基编辑效率,并在小鼠代谢疾病模型中验证了优化的IscB-ωRNA系统用于基因编辑
临港实验室胥春龙团队、新加坡国立大学胡纯一团队及厦门大学王乐韵团队合作,在 Cell Reports 期刊发表了题为Engineered IscB-ωRNA system with improved base editing efficiency for disease correction via single AAV delivery in mice 的研究论文。
该研究成功地通过工程改造转座子相关的CRISPR祖先系统:IscB-ωRNA系统,提高了IscB-ωRNA的基因敲除和碱基编辑效率,并在小鼠代谢疾病模型中验证了优化的IscB-ωRNA系统用于基因编辑治疗的可行性性。优化的微型IscB-ωRNA系统可以通过单个腺相关病毒(AAV)载体递送,在基因编辑治疗方面的巨大应用潜力。

在这项最新研究中,研究团队聚焦转座子相关的RNA引导核酸酶IscB,这是一种比传统的Cas9和Cas12蛋白小得多的CRISPR祖先蛋白。IscB具有微型蛋白尺寸,使其能够更容易地被包装进单个AAV载体中,从而适合进行体内递送。然而,天然的IscB蛋白在真核细胞中的基因编辑效率较低,限制了其广泛应用。
胥春龙团队通过IscB-ωRNA蛋白核酸复合物结构分析,对IscB关联的ωRNA进行了多轮的系统性工程改造,成功发现一种ωRNA*-v2的新变体,这种改良后的ωRNA显著提升了IscB的基因敲除和碱基编辑效率。在小鼠胚胎实验中,利用IscB-ωRNA系统成功地对Tyr基因和DMD基因进行了编辑,展示了这种系统在体内基因编辑中的巨大潜力。
此外,研究团队还对该系统的脱靶效应进行了深入分析。通过全基因组范围的PEM-seq分析,结果显示改造后的IscB-ωRNA系统在基因编辑过程中未引起显著的脱靶效应。同时,研究团队还进行了R-loop和RNA-seq分析,进一步评估miCBE和miABE的基因编辑特异性,发现与传统的SpCas9衍生的基因编辑器相比,IscB-ωRNA系统引起的非目标编辑数量较低,表现较好的特异性。
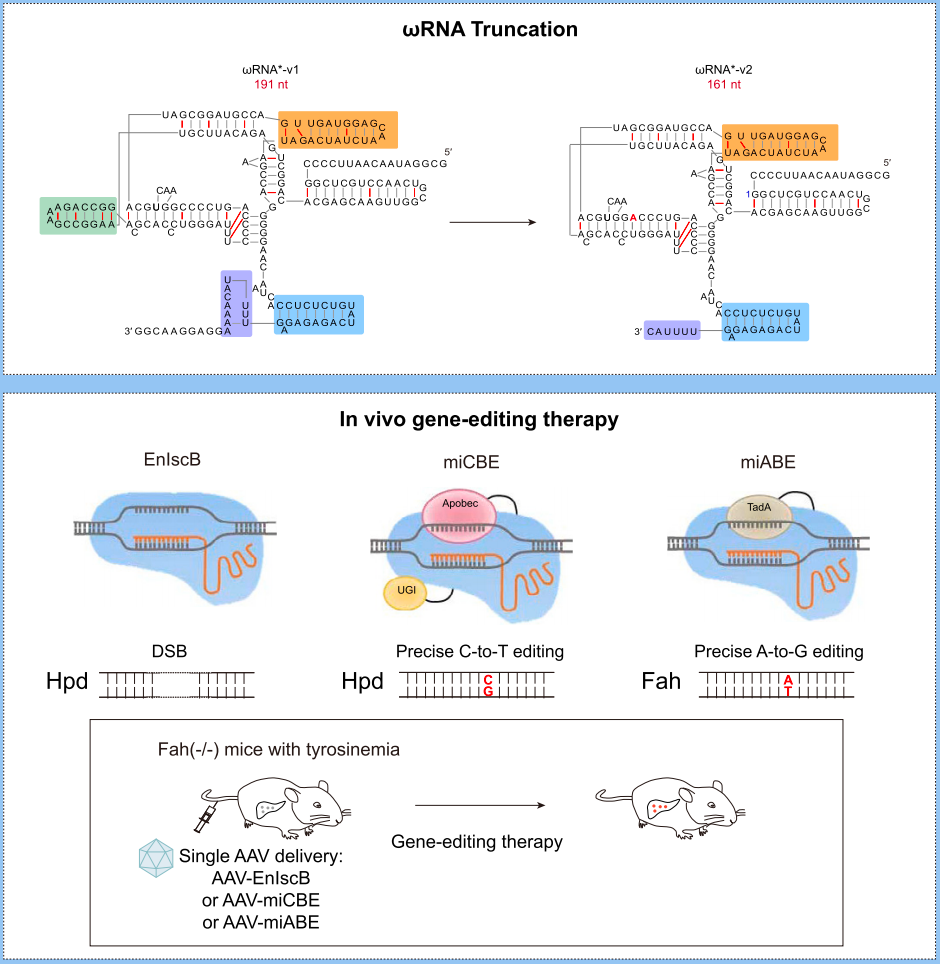
图1. 上面为工程化改造的ωRNA*-v2变体的RNA结构;下面为ωRNA*-v2引导的IscB基因敲除与碱基编辑工具及其在疾病小鼠模型中的应用
此外,研究团队在遗传性代谢疾病的小鼠模型中测试了这一工具的治疗效果。通过单个AAV递送IscB-ωRNA*的基因敲除与单碱基编辑系统,他们成功地修复了Fah基因中的单碱基突变,逆转模型小鼠的死亡表型并改善了患病小鼠健康状况。这一发现不仅证明了工程化改造的IscB-ωRNA系统在体内基因编辑中的有效性,还展示了其在疾病基因编辑治疗中的潜力。
临港实验室胥春龙研究员、新加坡国立大学胡纯一研究员及厦门大学王乐韵研究员为该论文共同通讯作者,临港实验室郭若晨博士、上海科技大学博士生孙潇智、新加坡国立大学博士生王飞佐、中国科学院脑科学与智能技术卓越创新中心博士生韩鼎毅为共同第一作者,该项工作获得临港实验室、上海市科委启明星计划(A类)等项目资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


