科学家揭示了吉非替尼/奥希替尼(GR/OR)的获得性耐药新机制
来源:生物谷原创 2023-03-15 13:35
非小细胞肺癌(NSCLC)是最常见的癌症组织学类型,约占癌症患者的85%。表皮生长因子受体(EGFR)突变作为NSCLC中的重要致癌驱动因素,为晚期疾病患者的生物标志物导向治疗模型拉开了帷幕。
非小细胞肺癌(NSCLC)是最常见的癌症组织学类型,约占癌症患者的85%。表皮生长因子受体(EGFR)突变作为NSCLC中的重要致癌驱动因素,为晚期疾病患者的生物标志物导向治疗模型拉开了帷幕。
许多EGFR酪氨酸激酶抑制剂(TKIs)已经开发出来,包括常用的第一代TKIs吉非替尼和高效的第三代TKIs奥希替尼。尽管这些药物在治疗患者方面疗效显著,但对这些药物的耐药性仍然是一个有待解决的根本挑战。

图片来源:https://pubmed.ncbi.nlm.nih.gov/36778111/
近日,来自首都医科大学的研究者们在Int J Biol Sci.杂志上发表了题为“Acquired resistance to EGFR-TKIs in NSCLC mediates epigenetic downregulation of MUC17 by facilitating NF-κB activity via UHRF1/DNMT1 complex”的文章,该研究表明吉非替尼/奥希替尼(GR/OR)的获得性耐药性促进UHRF1/DNMT1复合物抑制粘蛋白17(MUC17)的表达。GR/OR细胞中的MUC17可作为表观遗传传感器,用于生物监测对EGFR TKI的耐药性。
EGFR TKIs治疗给EGFR突变的非小细胞肺癌患者带来了显著益处。然而,大多数患者在治疗后最终产生获得性抵抗。本研究研究了MUC17在EGFR TKI获得性耐药细胞中的表观遗传效应。研究者们发现,GR/OR细胞增强全基因组DNA超甲基化,主要是在与多种致癌途径相关的5-UTR中,其中GR/OR细胞通过以剂量和时间依赖的方式下调MUC17表达而发挥促癌作用。
GR/OR通过促进DNMT1/UHRF1复合物依赖性启动子甲基化,从而激活NF-κB活性,从而获得耐药性介导的MUC17下调。MUC17通过促进MZF1的表达,增加IκB-α的生成并抑制NF-κB活性。体内结果还表明,DNMT1抑制剂(5-Aza)与吉非替尼/奥西美替尼联合使用可恢复对OR/GR细胞的敏感性。
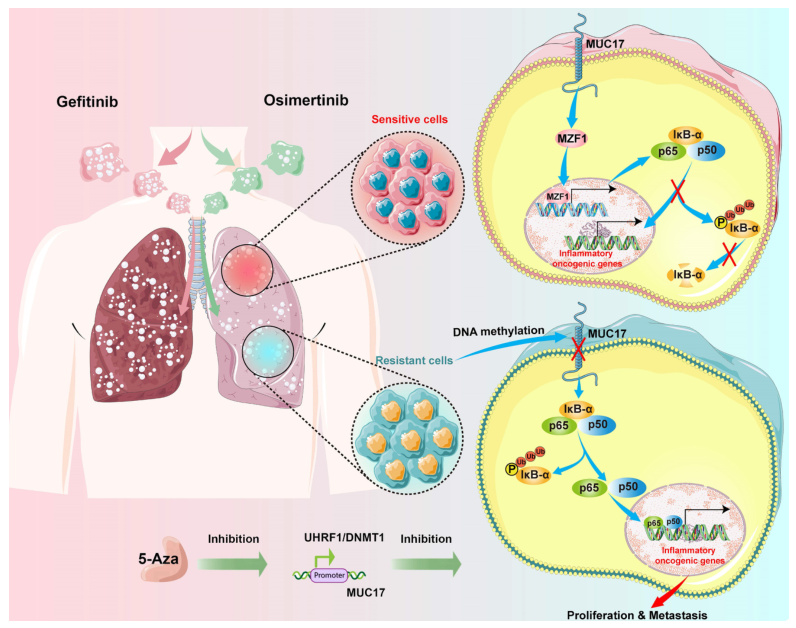
MUC17在耐药细胞中的分子机制示意图。
图片来源:https://pubmed.ncbi.nlm.nih.gov/36778111/
综上所述,长期接触吉非替尼/奥希替尼可通过UHRF1/DNMT1介导的MUC17表观遗传沉默增强全基因组甲基化,并促进肺癌细胞的耐药性。该结果表明,MUC17通过上调吉非替尼/奥希替尼耐药细胞中的MZF1表达和抑制NF-κB活性来促进药物敏感性。因此,MUC17可以作为一种表观遗传传感器,用于对EGFR TKI的耐药性进行生物监测。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


