Nat Biotechnol:利用造血干细胞制造的异体CAR-iNKT细胞有望作为现成的细胞疗法治疗一系列癌症
来源:生物谷原创 2024-07-13 10:47
iNKT 细胞可以改变肿瘤微环境,有选择性地有效消耗周围环境中最具免疫抑制作用的细胞,从而为攻击实体瘤提供了独特的机会。
免疫疗法利用人体自身的免疫系统攻击癌细胞,阻止肿瘤生长,从而彻底改变了癌症治疗方法。然而,这些疗法往往需要根据每位患者的具体情况量身定制,从而减慢了治疗进程,导致每位患者的治疗费用高达数十万美元。
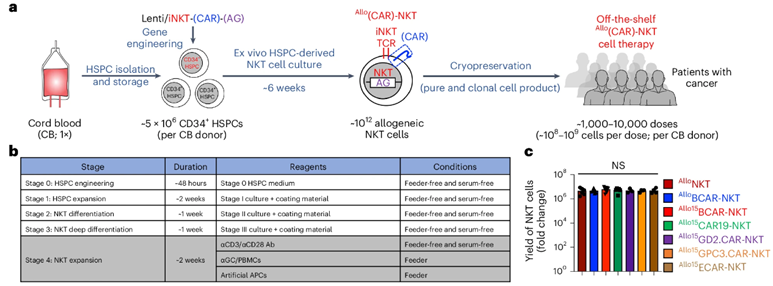
为了解决这些局限性,来自加州大学洛杉矶分校的研究人员在一项新的研究中开发出了一种新的临床指导方法,用于设计更强大的称为恒定自然杀伤细胞(invariant natural killer T cell, iNKT)的免疫细胞,可用于“现成的”癌症免疫疗法,即来自单一脐带血供体的免疫细胞可用于治疗多名患者。这一发现标志着向CAR-T细胞疗法等细胞疗法的大规模生产迈出了重要一步,使这些挽救生命的疗法更加经济实惠,更多患者可以接受。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Generation of allogeneic CAR-NKT cells from hematopoietic stem and progenitor cells using a clinically guided culture method”。论文通讯作者为加州大学洛杉矶分校微生物学、免疫学与分子遗传学教授Lili Yang博士。

2021年,Yang团队报告了一种利用造血干细胞生产大量iNKT细胞的方法。该系统需要使用三维胸腺类器官和支持细胞,这给生产和监管带来了挑战,阻碍了该方法的临床应用。
如今,他们开发出一种技术,能以无饲养细胞和无血清的方式利用造血干细胞产生大量iNKT细胞。这种方法上的升级消除了以前的障碍,使得他们比以往任何时候都更接近为患者提供 “现成的”癌症免疫疗法。
这些作者从15份代表不同遗传背景的捐献者脐带血样本中分离出造血干细胞,它们可以自我复制并产生各种血细胞和免疫细胞。据估计,一次脐带血捐献可产生1000到10000剂量的治疗药物,因此该系统非常适合制造“现成的”免疫疗法。
接下来,他们为iNKT细胞配备了嵌合抗原受体(CAR),这种分子能让免疫细胞识别并杀死特定类型的癌症,靶向治疗包括血癌和实体瘤在内的七种癌症。
由此产生的CAR-iNKT细胞对所有七种癌症都显示出了强大的抗肿瘤功效,这表明它们有望治疗多种癌症。随后在多发性骨髓瘤模型中,他们展现了CAR-iNKT细胞阻止肿瘤生长的能力,而且不会引起供体细胞移植到患者体内时可能出现的并发症。
使用 iNKT 细胞作为“现成的”癌症免疫疗法是最理想的,因为它们不会有移植物抗宿主病的风险,然而现有的大多数基于细胞的免疫疗法会产生移植物抗宿主病,因而必须根据患者的具体情况来设计的原因。
图片来自Nature Biotechnology, 2024, doi:10.1038/s41587-024-02226-y
美国食品药品管理局(FDA)从未批准过任何“现成的”细胞疗法。有了这项新技术,这些作者不仅展示了 iNKT 细胞的高产量,还证明了装有 CAR 的 iNKT 细胞在冷冻和解冻后不会失去抗肿瘤功效,而这正是通用细胞产品广泛分发的关键要求。
虽然 CAR-T 细胞疗法已成为治疗白血病和淋巴瘤等某些血癌的变革性疗法,但开发针对实体瘤的癌症免疫疗法却一直面临挑战。部分原因是实体瘤具有免疫抑制性肿瘤微环境,即免疫细胞的功能在肿瘤微环境中受损。
iNKT 细胞可以改变肿瘤微环境,有选择性地有效消耗周围环境中最具免疫抑制作用的细胞,从而为攻击实体瘤提供了独特的机会。这些作者指出这项技术有可能广泛应用于一系列血癌、实体瘤和其他疾病,如自身免疫性疾病。
就目前而言,免疫疗法(尤其是细胞疗法)的最大瓶颈是生产。截至2023年,FDA已经批准了六种自体CAR-T细胞疗法,每名患者每次治疗的平均成本约为30万美元。利用这项新技术扩大 iNKT 细胞的生产规模,免疫疗法的单剂量价格确实有可能大幅降至 5000 美元。
由于这种灵活的平台允许人们更换 CAR来靶向不同的癌症,Yang团队已将这一系统改造为靶向卵巢癌(最致命的妇科癌症之一)。从针对血癌到针对实体瘤,这是一个巨大的飞跃,他们希望能在未来几年内将这个项目带入临床试验。(生物谷Bioon.com)
参考资料:
Yan-Ruide Li et al. Generation of allogeneic CAR-NKT cells from hematopoietic stem and progenitor cells using a clinically guided culture method. Nature Biotechnology, 2024, doi:10.1038/s41587-024-02226-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


