《自然·代谢》:暨南大学/中山大学团队发现肠癌对抗血管药物耐药的全新机制!
来源:奇点糕 2023-09-18 10:58
总的来说,叶文才/张冬梅/陈敏锋/夏良平等人的这项研究表明,ENO2可能是肠癌对抗血管生成治疗耐药的潜在预测生物标志物,也是逆转耐药的治疗靶点从国际癌症研究机构(IARC)发布的数据来看,在2020年
从国际癌症研究机构(IARC)发布的数据来看,在2020年肠癌导致的死亡在所有癌症中排名第二[1]。
具体到我国来看,2020年新发肠癌病例约55万,在所有癌症中排第二位;有28万人因肠癌死亡,在所有癌症中排第五位[1]。我国居民的肠癌负担十分沉重。
抗血管生成药物是治疗肠癌的主要药物,然而,在临床治疗过程中,很多患者对抗血管类药物产生了耐药。虽然相关的机制研究有很多,但目前仍没有可以转化到临床的可行方案。亟需寻找新的耐药机制,开发更有效的联合治疗方案。
近日,由暨南大学药学院叶文才/张冬梅/陈敏锋,以及中山大学肿瘤防治中心夏良平领衔的研究团队,在著名期刊《自然·代谢》上发表一项重要研究成果[2],揭示了一条促进肠癌对抗血管药物耐药的不同寻常的机制。
他们发现,烯醇化酶2(ENO2)是肠癌对抗血管生成药物耐药的关键驱动因素,它的过表达会诱导肠癌细胞的神经内分泌分化,促进肠癌细胞的恶性行为,并使肠癌细胞对抗血管生成药物脱敏。抑制ENO2的表达或活性,可以让耐药肠癌细胞重新对抗血管生成药物敏感。

论文首页截图
通过比较对抗血管生成药物敏感或耐药肠癌细胞的蛋白组学数据,叶文才团队发现烯醇化酶2(ENO2)在耐药的肠癌细胞中高表达。
ENO2是神经内分泌分化的重要标志物,因此也被称为神经元特异性烯醇化酶。有研究表明,在前列腺癌和小细胞肺癌等癌症中,ENO2的过表达与患者预后不良有关。
已经有研究发现,抑制ENO2的活性,可以提高肠癌对BRAF抑制剂的敏感性[3],以及促进胶质母细胞瘤对放疗和化疗敏感[4]。ENO2与肠癌对抗血管生成药物耐药之间的关系,还无人知晓。
在分析TCGA数据库中的肠癌数据之后,叶文才团队发现,与ENO2低表达的肠癌患者相比,ENO2高表达的肠癌患者总生存(OS)时间更短。此外,与不响应抗血管生成药物贝伐珠单抗治疗的肠癌患者相比,响应贝伐珠单抗治疗的肠癌患者ENO2表达水平较低。

ENO2表达水平与总生存和药物治疗之间的关系
再确认ENO2表达水平影响肠癌对抗血管生成药物的敏感性之后,叶文才团队探索了背后的分子机制。
具体而言,在肠癌细胞糖酵解的过程中,ENO2会将2-磷酸甘油酸转化为磷酸烯醇丙酮酸(PEP),PEP会直接与组蛋白去乙酰化酶1(HDAC1)结合,并抑制HDAC1的活性;如此一来,β-catenin的乙酰化水平就会增加,导致对肿瘤细胞增殖/分化至关重要的Wnt–β-catenin通路被激活,β-catenin下游的靶基因(CD44、Cyclin D1、c-Myc、ASCL2和LGR5等)表达水平升高。
上面的一些列信号变化,会带来两个后果,一个是肠癌细胞的神经内分泌分化(恶性行为),第二个就是对抗血管生成药物产生耐药。好消息是,靶向ENO2的药物AP-III-a4和POMHEX,可以有效抑制ENO2的活性,逆转上述两个不良的后果。
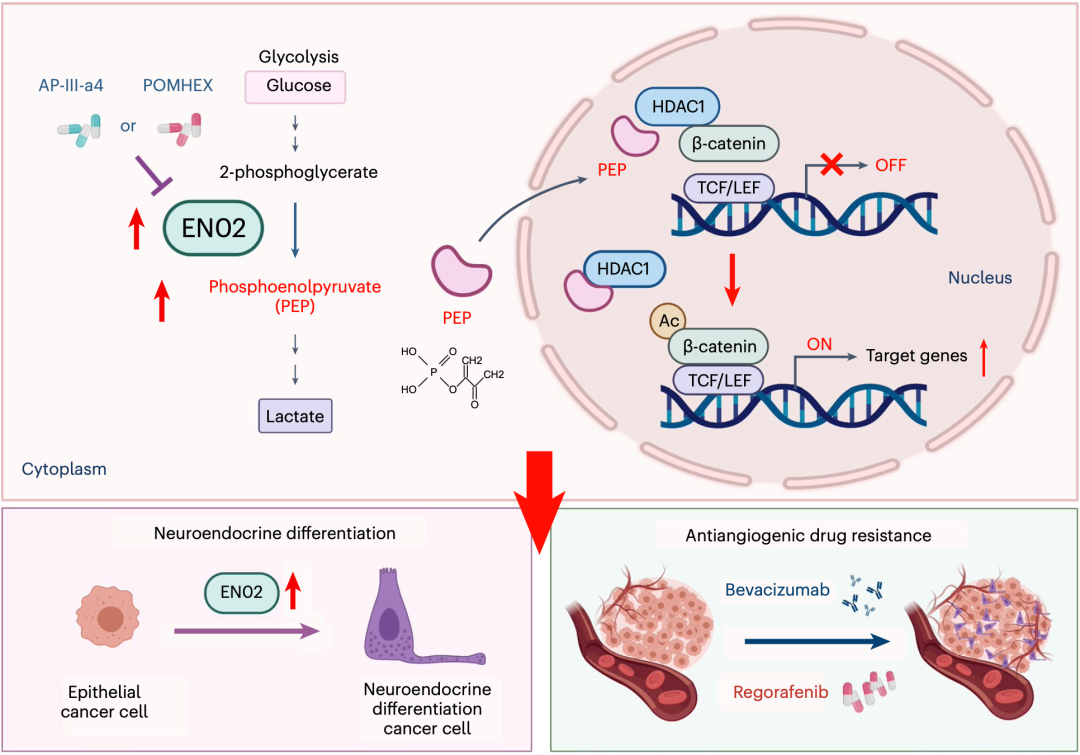
机制示意图
在研究的最后,叶文才团队将两种ENO2抑制剂分别与两种常用的抗血管生成药物联合使用,了解这种治疗方案的治疗潜力。
他们发现,联合用药可以有效地逆转肠癌细胞对抗血管生成药物的耐药,抑制肿瘤在小鼠身上的生长。
在分析小鼠的肿瘤组织之后,他们还发现,联合用药抑制了ENO2的表达/活性,降低了β-catenin的乙酰化水平。
总的来说,叶文才/张冬梅/陈敏锋/夏良平等人的这项研究表明,ENO2可能是肠癌对抗血管生成治疗耐药的潜在预测生物标志物,也是逆转耐药的治疗靶点。
接下来,有必要在临床研究中探索ENO2抑制剂联合抗血管生成药物治疗肠癌的效果。
期待研究团队带来好消息。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


