Nature子刊:中科院深圳先进院傅雄飞团队利用定量合成生物学探索细胞命运决定新机制
来源:生物世界 2023-03-27 10:46
该研究运用造物致知的研究范式,通过定量实验和数理模型,深入探索细胞生长速率对经典人工合成基因线路——互抑制回路【1】——的双稳态性的影响,发现了不同基因的表达量对生长速率呈现不平衡、不同步的响应,进而
细胞分化使得基因型相同的细胞产生在形态、结构和生理功能上差异的细胞。对于细胞分化过程的发生,经典表述认为细胞的基因功能以及它们形成的复杂调控网络在时空上控制了基因的表达量,从而编程了细胞命运决定(fate determination)的过程。尽管,我们可以解析绝大部分基因的功能,测量基因表达的时空动力学,并绘制出基因调控网络的草图;但是,在细胞命运决定过程中,我们仍然无法理解基因差异表达的源头是什么,也无法精确预测命运决定过程的走向。
中国科学院深圳先进技术研究院合成生物学研究所傅雄飞团队在 Nature Chemical Biology 期刊发表了题为:Unbalanced response to growth variations reshapes the cell fate decision landscape 的研究论文。
该研究运用造物致知的研究范式,通过定量实验和数理模型,深入探索细胞生长速率对经典人工合成基因线路——互抑制回路【1】——的双稳态性的影响,发现了不同基因的表达量对生长速率呈现不平衡、不同步的响应,进而重塑细胞命运决定景观(Landscape)。该研究提出:生长速率可以在全局上调控基因表达网络中每个基因的表达水平从而改变细胞命运,并不一定依赖特定调控因子。
该研究为命运决定调控机制研究提供了新视角,也为通过合成生物方法定量控制细胞命运用于医学和工业用途提供了新思路。

科学家们通过生物化学和分子生物学手段,研究基因的功能和调控关系、以及信号的传导机制,绘制出了细胞命运决定网络的草图;合成重构了功能基因网络,例如:双稳态开关【1】、生物振荡【2】、斑图形成【3】,让人类在造物之路上迈出了跨越式的脚步。然而,抛开该网络中基因的细节,我们仍然无法理解在细胞命运决定网络中,信息是如何传递的;也无法完美预测该网络运行的状态,进而推断出细胞命运的走向。如果我们跳出网络的细节,从全局的范围来看整个网络,是否存在特别的因素能够重塑细胞命运决定景观(Landscape),甚至涌现出新的功能呢?
细胞生长速率依赖的表型双稳态性
为了研究细胞的生长速率对基因网络是否可以存在影响,科研团队利用了经典合成基因线路——拨动开关线路(the toggle switch)【1】,来研究这种可能性。拨动开关线路由两个相互阻遏的基因所构成,使得该线路在稳态(stable states)下只能存在一种基因处于高表达状态。这样的网络拓扑结构也广泛存在于自然界中,例如:λ噬菌体溶菌-溶原决定,线虫左右味觉神经分化。另外,构成这一线路的元件已经被广泛定量表征,与宿主自生基因调控网络相正交,因此可以排除宿主自身状态对基因线路的直接调控,同时也利于定量分析网络的稳态行为。
科研团队偶然发现,在SOB培养基中,细胞的初始状态无论是红色状态还是绿色状态,细胞在经历一步生长的过程,平台期的细胞都会处于红色状态(图1)。故此推测,可能存在某种全局性的生理变化影响了细胞命运决定决策。
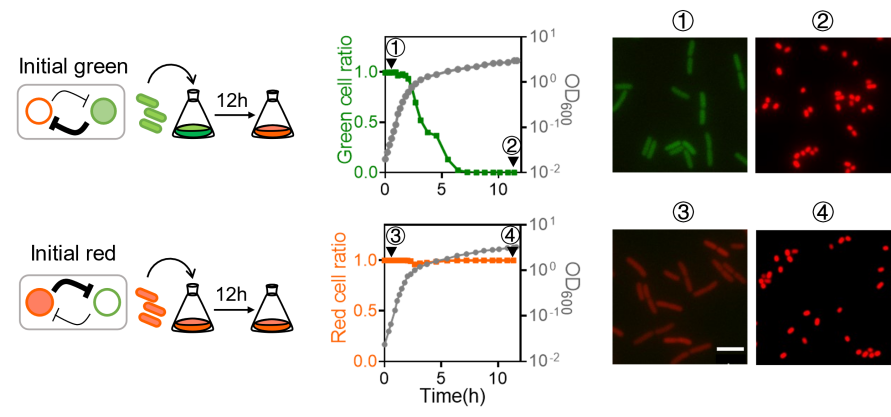
图1: 无论初始状态是红色还是绿色,细胞在平台期都会处于红色状态,绿色细胞在进入平台期前会自发向红色状态切换。
受到细菌生理学研究工作【4-6】的启发,科研团队在不同的细胞生理稳定状态(physiology steady state)下,观察了拨动开关线路的稳态特征以及双稳态性。实验结果表明,基因线路的双稳态性与细胞的生长速率存在关联关系(图2)。当细胞生长速率大于0.5 h-1 时,拨动开关存在双稳态性,当细胞生长速率低于这一临界生长速率时,拨动开关的双稳态性出现了分岔(bifurcation),也就说,细胞在慢速生长状态下,只能维持红色稳态,线路的双稳态性消失了。进一步而言,似乎可以存在这样的可能性:生长速率的变化可以引起命运决定网络稳态特性,并左右细胞的命运走向。
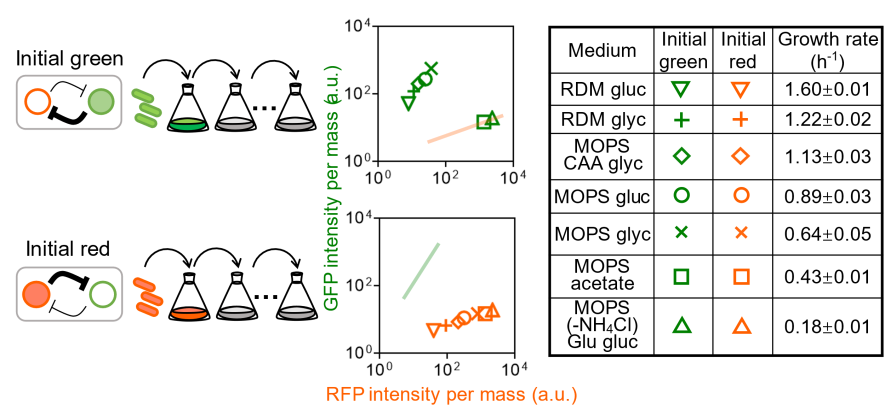
图2: 在不同培养条件下,细胞的稳态状态与数量将发生变化,当细胞生长速率低于0.5h-1时,细胞只存在红色一个稳定状态。
基因表达对生长速率变化的响应的不平衡性
为了进一步揭示细胞生理状态变化是如何主导细胞的命运决定过程,科研团队定量表征了不同生长状态下拨动开关中两个阻遏蛋白的表达水平。首先,科研团队发现,两个基因的表达水平会随着细胞生长速率放缓呈现出上升趋势,同时,上升的速率大于细胞生长放缓带来的稀释速率降低的影响;据此,科研团队推断两个基因的翻译速率也随细胞生长速率发生了变化。科研团队利用荧光蛋白定量表征、转录组学数据,发现两者的表达水平尽管在总体趋势上都是呈现出与细胞生长速率负相关的关系,但表达速率的最大峰值以及相对变化值是不尽相同的(图3a)。利用数理模型,科研团队评估了这种非平衡的生长速率依赖的基因表达模式对基因线路稳定性的影响(图3b,c),并证明了这种生长速率的依赖性给拨动开关的双稳态性带来了分岔的可能(图3d)。
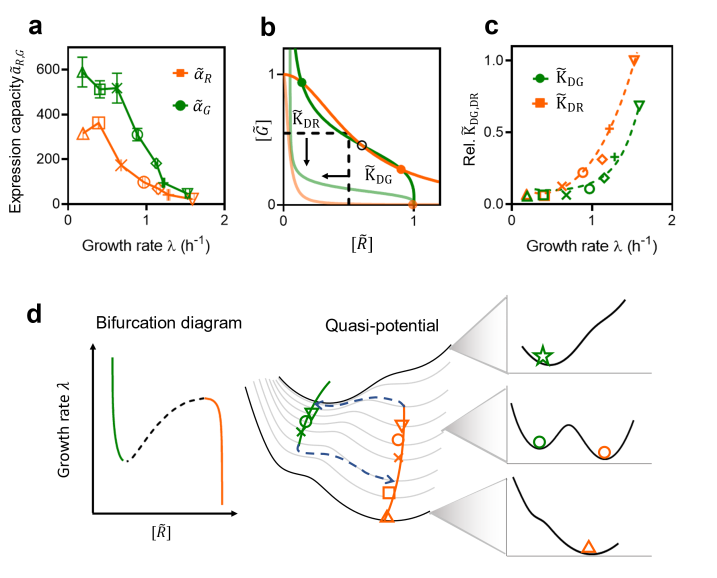
图3: 实验与模型分析,生长速率依赖的基因表达可以重塑细胞的命运决定景观图。
临界生长速率的决定机制
通过进一步分析数理模型,科研团队发现拨动开关发生分岔的临界生长速率也可以被阻遏蛋白的阻遏阈值(解离常数)所调控。通过改变LacI 结合位点序列,可以改变LacI 蛋白对TetR蛋白表达的阻遏阈值;由此,团队得到了阻遏强度与原始序列(LO1)更强的两个突变体,LO2和LO3,通过定量实验,测定了三者的阻遏阈值,以及不同生理条件下的稳态状态与数量(图4)。科研团队发现,相较于LO1, LO2表现出在实验可测的生长速率范围内均具有双稳态性,而LO3则表现为,在生长速率大于临界生长速率时,呈现出绿色状态的单稳态,速率低于临界生长速率时则呈现双稳态性。这一结果与数理模型的预测一致。
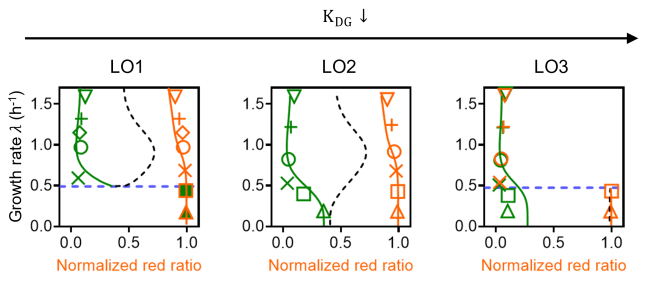
图4: 改变阻遏蛋白的阻遏阈值可以平移基因线路对生长速率响应的分岔图。
分岔点的附近的动力学行为
在稳态条件下,生长速率可以重塑细胞的命运决定景观。另一个重要的问题是:细胞的生命活动过程是一个非平衡的系统,那么细胞命运的决策是如何在变动的环境下发生的?
科研团队通过扰动细胞生长速率来探究这一问题,通过动态改变培养基的成分,来实现细胞生长速率切换,并实时追踪细胞的状态。首先将细胞在快速生长条件下培养至生理稳定状态,再切换到营养贫瘠的培养基(生长降档),等细胞恢复到生理稳定状态再切换回到营养丰富的培养基(生长升档)。由此发现,初始状态为绿色状态的LO1菌株在生长降档过程最初阶段,红绿两种状态都同时发生升高;随着红色状态的升高,绿色状态开始下降,并最后稳定在红色状态。而LO3菌株,由于在慢速生长条件下为双稳态,全过程维持绿色状态不变。科研团队将LacI和TetR的表达速率与瞬时生长速率之间进行了准稳态近似,构建了基因线路的确定性动力学模型,该模型能很好地捕捉细胞在升档和降档过程中的动力学特征。
有趣的是,LO2菌株在生长降档过程中,细胞发生了分化,一部分细胞仍能维持绿色状态,而一部分细胞分化为红色,尽管,该菌株在任何生长速率范围内都表现为双稳态。这一现象无法被确定性的动力学模型所预测。科研团队利用势能景观图(potential landscape),定量地研究了不同生长速率下,基因表达的噪声对细胞的命运决定的影响,而后发现,当细胞生长速率处于较慢或者较快时,势能景观中,两个稳定态之间的能垒较低,这意味着细胞更容易因噪声而发生状态的切换;因而,LO2菌株在处于降档过程中,一部分细胞在随机性的推动下发生状态切换。
因此,细胞的命运决定过程可以通过两种方式决定:1.确定性机制,网络的稳态性质变化,而引起细胞群体完全发生状态切换;2.通过噪声驱动,在临界点附近发生状态的跳转,以控制部分群体发状态的切换。

图5: 不同基因线路对生长波动具有不可逆或可逆的命运决定轨迹。
总之,为了确定生长速率和命运决定之间的作用关系,科研团队运用了定量合成生物学手段,分析了双稳态基因线路中,基因表达的生长速率关系,以及随之而来的基因线路状态变化。在不同的营养条件下,通过定量线路的稳定状态的数量和细胞命运决定的动力学过程,研究获得了大量结果实验结果,并阐明如何利用生长变化来重塑命运决定景观:
1、基因表达和细胞生长速率之间的全局相互依赖性在调控网络上并完全对等。对生长变化的不同步响应导致命运决定景观的分岔。这种重塑过程不依赖于特定的分子信号或调控线路,而是细胞生理全局调控机制对命运决定网络调控的内在特征。
2、生长变化驱动的表型状态转换受到命运决定景观变化的控制。根据实验的定量观察构建了唯象数理模型,揭示了这一现象背后的机制,并预测了生长速率介导的细胞命运决定的动态过程。
3、科研团队使用了经典合成线路来模拟命运决定调控网络中的关键节点,排除网络中其他基因调控可能带来的影响,并可以对网络中关键参数进行精细控制。此外,还提供了一种提升基因线路对生长扰动的稳健性的方法,促进了基因线路在生物计算和动态控制生物过程中的应用。
中科院深圳先进院合成所傅雄飞研究员为该论文通讯作者,助理研究员朱静雯和博士研究生储攀为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


