《自然》:压力大免疫差的原因找到了!科学家首次找到压力下,大脑直接调控白细胞活动的特定神经通路
来源: 奇点糕 2022-06-14 17:44
当我们压力大的时候就容易出现免疫力下降的情况,比如我们相比平时会更容易患感冒,或者病情会拖更久。
当我们压力大的时候就容易出现免疫力下降的情况,比如我们相比平时会更容易患感冒,或者病情会拖更久。
那么心理压力究竟是如何调控我们的免疫系统的呢?
近日,来自美国西奈山医学院心血管研究所Filip K. Swirski团队通过小鼠模型解开了这一谜题。
他们发现在急性应激后小鼠体内的白细胞,包括中性粒细胞、单核细胞、B细胞和T细胞,会在组织分布上发生显著变化。而白细胞的这一系列变化竟由特定神经回路直接调控[1]!
通过不同疾病模型的小鼠,他们还发现急性应激可以缓解自身免疫病(自身免疫性脑脊髓炎, EAE)的病情,但是却会加重SARS-CoV-2和流感病毒导致的感染。
这项研究首次阐明了在急性应激和压力之下,特定神经回路是如何调控免疫细胞的运动的。
此项重要的研究成果发表在顶级期刊《自然》杂志上。

图1. 论文标题
在此之前,来自斯坦福大学的Bruce S McEwen团队曾报道过急性应激下中枢神经系统(CNS)可以调控免疫细胞。但是他们的研究仅限于阐明了压力相关的神经递质可以引起免疫细胞分布的改变,并没有探究是具体哪些脑区和神经回路参与其中[2]。
Filip K. Swirski团队在这个基础上,开始探究小鼠在其他应激模型中(主要为束缚应激)白细胞分布的变化以及神经回路调控机制。

图2. Filip K. Swirski 教授
那下面就跟着奇点糕来看看他们是如何展开研究的吧。
首先,经过分析一小时束缚应激后小鼠体内白细胞的变化,作者们发现外周循环中的单核细胞和淋巴细胞(B细胞和T细胞)显著减少,而中性粒细胞却增加了。
通过不同时间点的采样,他们发现:在应激过后的恢复期,单核细胞和淋巴细胞数量逐渐减少,之后恢复到基线;而中性粒细胞数量则迅速上升并急剧恢复到基线。短至30s的束缚应激就已足够触发中性粒细胞的改变,而淋巴细胞和单核细胞的数目变化却至少需要4h的束缚应激。
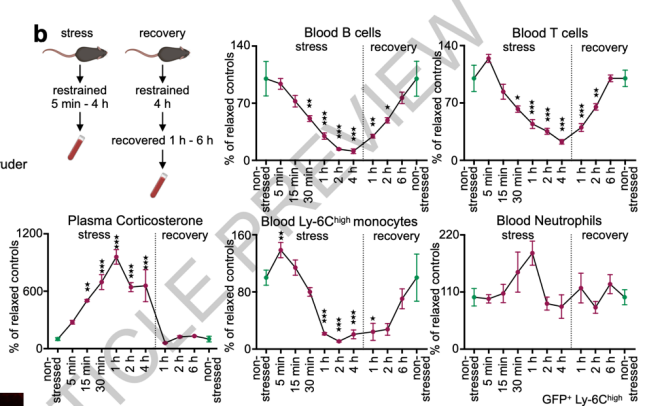
图3.白细胞在束缚应激后的动态学
接下来的问题就是减少的单核细胞和淋巴细胞去向了何处呢?以及增加的中性粒细胞是从何而来呢?
利用移植和细胞标记技术,作者们发现急性应激下,单核细胞和淋巴细胞从外周器官转移至了骨髓中,然后渐渐从骨髓中迁移回外周器官;中性粒细胞则是与此相反,它们在急性应激下被迁出骨髓,来到外周循环。
看到了急性应激下白细胞的分布变化,作者们接下来探究了背后的神经调节机制。由于下丘脑-垂体-肾上腺轴(HPA)在应激下会被激活,因此他们首先测试了HPA轴是否促进了白细胞分布上的改变。
作者们发现肾上腺切除术(消除了皮质醇的分泌)后,血液中单核细胞和淋巴细胞的减少现象就消失了,也就是说HPA轴的确参与其中。此外,他们注意到单核细胞和淋巴细胞在束缚应激下会高表达CXCR4,而CXCR4是受糖皮质激素调节的骨髓驻留及趋化因子。当CXCR4信号被抑制时,这些细胞从外周转运到骨髓的现象就被抑制了。
这些数据表明,急性应激时,HPA轴通过皮质酮-CXCR4信号通路来实现单核细胞和淋巴细胞从外周循环向骨髓的迁移。
由于HPA轴在下丘脑处一个很重要的区域是下丘脑室旁核(PVH),作者们接下来将注意力转向了PVH。他们发现只要特异性激活PVH的CRH神经元就可以增加外周皮质酮水平,这可以显著减少外周循环中的单核细胞和淋巴细胞。而当他们去除PVH的CRH神经元或者敲除了这些神经元的CRH基因时,单核细胞和淋巴细胞的迁移现象就消失了。
因此,以上的数据表明HPA轴中PVH-CRH通路的激活导致了外周循环单核细胞和淋巴细胞向骨髓的转移。
然而,这并不能解释中性粒细胞的变化。

接下来,作者们开始探究是什么神经信号使得应激下外周循环中性粒细胞得以增多。
作者们发现应激可以导致血清中性粒细胞调节剂CXCL1的显著增加,并且其增势与中性粒细胞向外周循环的迁移动态高度相关。当CXCL1信号被抑制时,中性粒细胞在束缚应激后的迁移就消失了,与此相反,注射重组CXCL1则可以诱导中性粒细胞向外周循环迁移。这些都指明CXCL1是促进应激下中性粒细胞迁移的原因。
那束缚应激期间CXCL1来自何处呢?作者们发现,相比于其他组织,骨骼肌Cxcl1 mRNA的表达增加得最显著。有趣的是,这同样是受CNS调节的。
由于骨骼肌是运动回路的最下游,作者们将注意力投向了中央运动回路。他们发现特异性激活大脑的运动回路会引发骨骼肌产生CXCL1,与此同时,伴随着血清中升高的CXCL1,血液里中性粒细胞也增多了。
因此,应激导致的中性粒细胞增多是中枢运动回路控制的骨骼肌活动的结果。
以上的研究说明,一方面,急性应激可以将大量的中性粒细胞动员到外周循环中,理论上它们接着可以渗透到外周器官中参与炎症的发生;另一方面,急性应激可以短暂性阻止淋巴细胞占据淋巴结,从而潜在地限制了获得性免疫反应。
为了深入了解急性应激对于不同炎症性疾病的影响,作者们利用了自身免疫病小鼠模型和病毒感染小鼠模型展开了研究。
首先,作者们发现,自身免疫性脑脊髓炎(EAE)小鼠在束缚应激后,淋巴结和脊髓中的B细胞和T细胞数量显著减少,而与此同时骨髓中的这些细胞数量则增加。他们还发现受到压力的小鼠具有较低的EAE临床病理评分,病程进展也得到了减缓。为了将应激对自身免疫病的影响与相关脑区联系起来,他们在EAE的诱导阶段特异性激活了PVH中的CRH神经元,发现与束缚应激后的结果一致。因此,这些数据表明,急性应激对于自身免疫病可能具有保护作用。
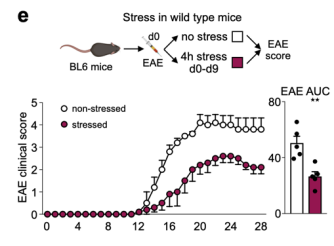
图4. 小鼠在应激后EAE病理评分统计
那么,在病毒感染模型中,我们还可以看到这种保护作用吗?答案是否定的。
作者们在建立的SARS-CoV-2和流感病毒感染模型中发现,早期的束缚应激会导致组织病毒载量较高,使得小鼠死亡率更高或者病理更严重。与此同时,他们也证实了应激下相关淋巴结中淋巴细胞的数目较少,并且在流感病毒模型中还可以看到应激小鼠支气管肺泡灌洗液中的特异性抗体也较少。这些数据表明,病毒暴露早期的急性应激会损害机体的获得性免疫力。
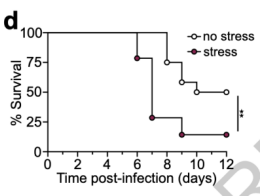
图5.SARS-CoV-2 病毒模型小鼠在应激后的生存曲线
综上,此项研究揭示了大脑不同区域和神经回路在压力应激情况下对免疫系统的调节,还阐明了应激对于不同炎症性疾病病情发展的影响,具有潜在临床指导意义。
参考文献:
[1] Poller WC, Downey J, Mooslechner AA, et al. Brain motor and fear circuits regulate leukocytes during acute stress [published online ahead of print, 2022 May 30]. Nature. 2022;10.1038/s41586-022-04890-z. doi:10.1038/s41586-022-04890-z
[2] Dhabhar FS, Malarkey WB, Neri E, McEwen BS. Stress-induced redistribution of immune cells--from barracks to boulevards to battlefields: a tale of three hormones--Curt Richter Award winner. Psychoneuroendocrinology. 2012;37(9):1345-1368. doi:10.1016/j.psyneuen.2012.05.008
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


