《自然》重磅:阿尔茨海默病毒蛋白的真面目,终于显露了!科学家借助原位成像技术,首次看清脑内Aβ沉积和tau蛋白缠结
来源:奇点糕 2024-07-16 14:17
为了确认复杂大脑内Aβ和tau的位置,研究者使用了能够结合淀粉样蛋白的荧光标记物甲氧基-X04(MX04),再通过cyto-CLEM来完成成像。
英国利兹大学科学团队在《自然》杂志发文,研究者们利用冷冻光电联用(cyto-CLEM)技术,首次完成了阿尔茨海默病(AD)患者脑内β淀粉样蛋白(Aβ)沉积和tau蛋白缠结的原位成像,精度达到2.38Å。此前,我们只能将病理蛋白提纯后进行成像分析,并不了解它们处于病生理环境中的形态。
研究结果显示,Aβ细丝排列相当“随意”,具有分支结构,其间还夹杂着细胞外囊泡、液滴、膜碎片等细胞成分;相对的,tau蛋白细丝则排列得非常整齐,能缠出这么规整“线团”的人肯定是个强迫症。
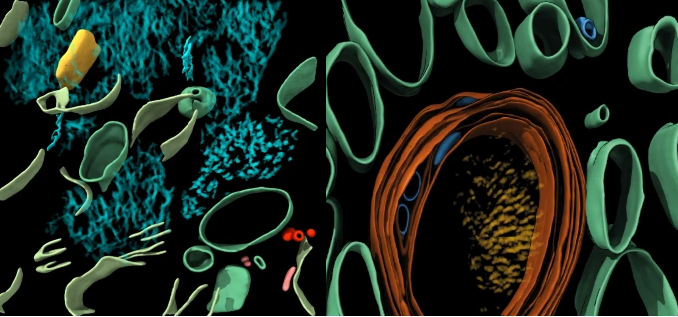
左Aβ(蓝绿色),右tau(橙红色)

论文题图
此前已经有不少通过冷冻电镜技术解析Aβ和tau结构的研究,但那些研究采用的样本普遍是从AD患者或模式动物大脑内提纯的蛋白。这虽然让结构分析变得更容易,但却不能百分百代表这些蛋白在AD脑内实际的结构状态,而我们知道,蛋白结构对其功能的意义非常重要。
为了确认复杂大脑内Aβ和tau的位置,研究者使用了能够结合淀粉样蛋白的荧光标记物甲氧基-X04(MX04),再通过cyto-CLEM来完成成像。
分析样本来自一位70岁的女性AD患者,她在54岁时出现记忆问题,58岁确诊痴呆,在进行性痴呆12年病史时经神经病理学确诊AD。该患者没有痴呆家族史,基因型为APOE3/3。
病理分析显示,该患者的颞中回含有丰富的淀粉样斑块、tau缠结/细丝、少量的脑淀粉样血管病理,不存在其他常见神经退行性疾病相关的病理学。
脑样本在患者死后约6小时取出经液氮急冻保存。这种保存方式会产生冰晶,所以研究者们将其解冻后,在高压下进行-188℃急冻,制备成70nm的薄片,以符合cyto-CLEM的成像要求。
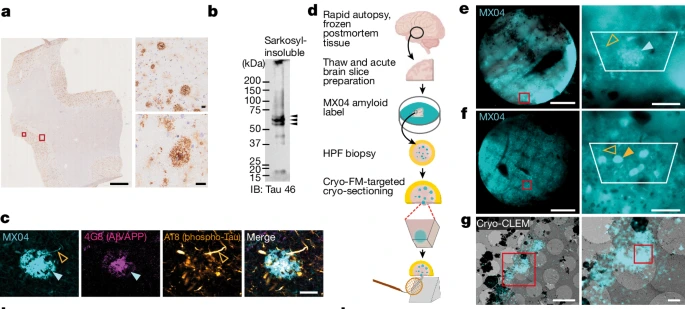
实验过程
乍一看去,Aβ斑块内的原纤维排列成平行的阵列或晶格,与研究者们之前分析FAD小鼠脑内蛋白斑块结构比较一致。可见Aβ细丝存在分支和交叉,方向不受相邻细丝影响,Aβ细丝间还散布着细胞外囊泡、液滴、70-200nm大小的长方体颗粒和膜碎片。
研究者认为膜碎片可能是大脑样品冻融导致的。对小鼠大脑进行冻融后成像,也能观察到类似的膜碎片,但如果直接高压冷冻切片就没有膜碎片。
至于那些神秘的长方体颗粒,研究者发现它内部表现出高密度的间隔条纹,令人联想到一些脂蛋白颗粒,但真相不明。
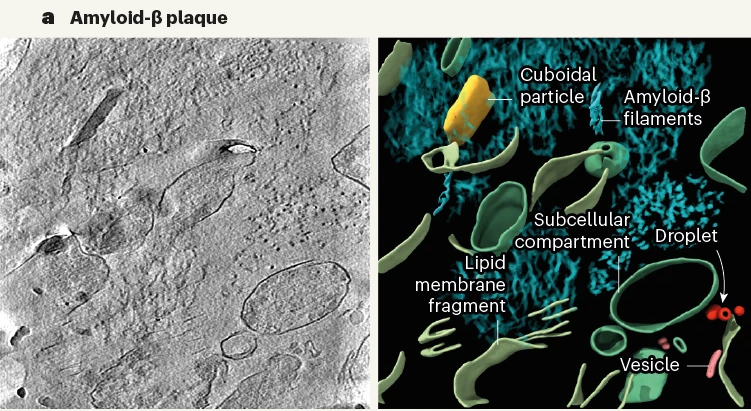
左电镜,右重建3D
tau细丝则排列成300-800nm的平行簇,相邻细丝以相同的方向和极性排列在一起。研究者在神经突的细胞质和有髓轴突中发现了tau沉积,但在细胞外也发现了一簇这种蛋白,不知道是不是样品制备导致的。
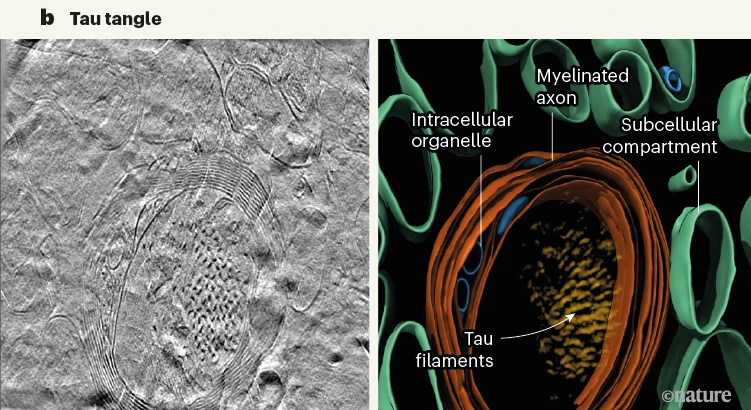
左电镜,右重建3D
此前有研究发现,AD中的tau细丝存在成对的螺旋细丝和直细丝两种形态,在本研究的分析结果中,两种形态的tau细丝也不会混合,而是更倾向于同类型排列在一起。
研究者认为,这是tau细丝之间的极性相互作用导致的非随机排列,而Aβ细丝由于较小,可能不足以实现类似的相互作用。
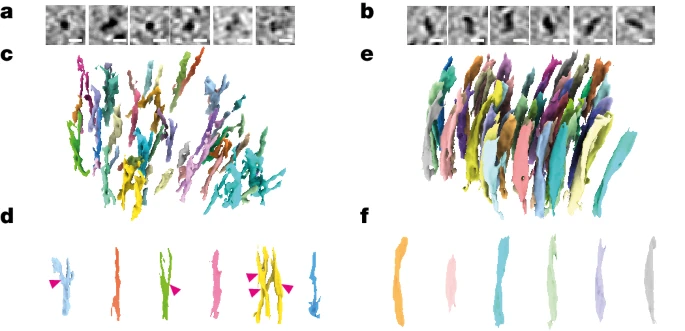
Aβ(左)tau(右)细丝的排列形态
研究者认为,这项研究使用的技术也可以用于分析其他神经退行性疾病中的丝状病理蛋白,最起码tau蛋白就在皮质基底节变性、进行性核上性麻痹等疾病中有关键作用。也有研究发现,在不同的神经退行性疾病中,tau病理的结构是不同的。
这些发现将为开发疾病模型、研究疾病潜在分子机制和开发新疗法提供有力的工具。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


