改变PROTAC研发逻辑获得最新进展
来源:网络 2023-04-21 15:06
总之,这项研究通过将分合纳米平台和多肽自组装技术应用于PROTAC技术中,成功开发了一种新型的药物研发平台SM-PROTAC,它具有高效、可靠、节省时间等优点,在药物研发领域具有广阔的应用前景。
近日,北京大学深圳研究生院李子刚/尹丰课题组,在期刊Journal of the American Chemical Society上发表了题为 “Targeted biomolecule regulation platform: a Split-and-Mix PROTAC approach” 的研究论文,报道了一种多肽自组装形成的Split-and-Mix PROTAC(SM-PROTAC),并在在ERα、EGFR、MEK1/2、BRD2/4、CDK4/6、AR、BCR-ABL等多个靶标上取得了明显的降解效果。
靶向蛋白降解技术(Proteolysis targeting chimeras,PROTAC)作为一种新兴的蛋白降解技术,具有靶向不可成药靶点、克服耐药性等小分子抑制剂不可比拟的潜在优势,正处于快速发展时期。但PROTAC底层专利技术主要被发达国家掌握。如何突破现有格局,开发具有自主知识产权的PROTAC技术对中国生物医药产业的发展是一个重要的课题。
从不同生物分子在相互识别后就可以发挥其生物学功能这一现象出发,本文作者假设,分合(Split-and-Mix)纳米平台可作为自调节平台,容易筛选投入组装的配体分子和调节组装过程中的配体比例。作者运用PROTAC技术作为例子,验证了分合纳米平台的概念,并提出了多肽自组装形成的分合PROTAC(SM-PROTAC)纳米球设计理念。分合PROTAC(SM-PROTAC)与传统小分子PROTAC不同,其将靶向E3泛素连接酶的配体小分子和靶标蛋白的配体小分子分开成两个模块,然后将二者混合溶解后进行组装。最终组装成直径在50—300 nm范围内的纳米球(SM-PROTAC)。这样的纳米球表面同时含有多个靶向E3配体小分子和多个靶向靶标蛋白的配体小分子,从而招募E3泛素连接酶和靶标蛋白。由于邻近效应,靶标蛋白会被E3泛素连接酶打上泛素标签,从而被蛋白酶体识别并降解。SM-PROTAC可以省去传统小分子PROTAC需要费时费力去筛选linker的过程,因此缩短了开发PROTAC需要的时间。
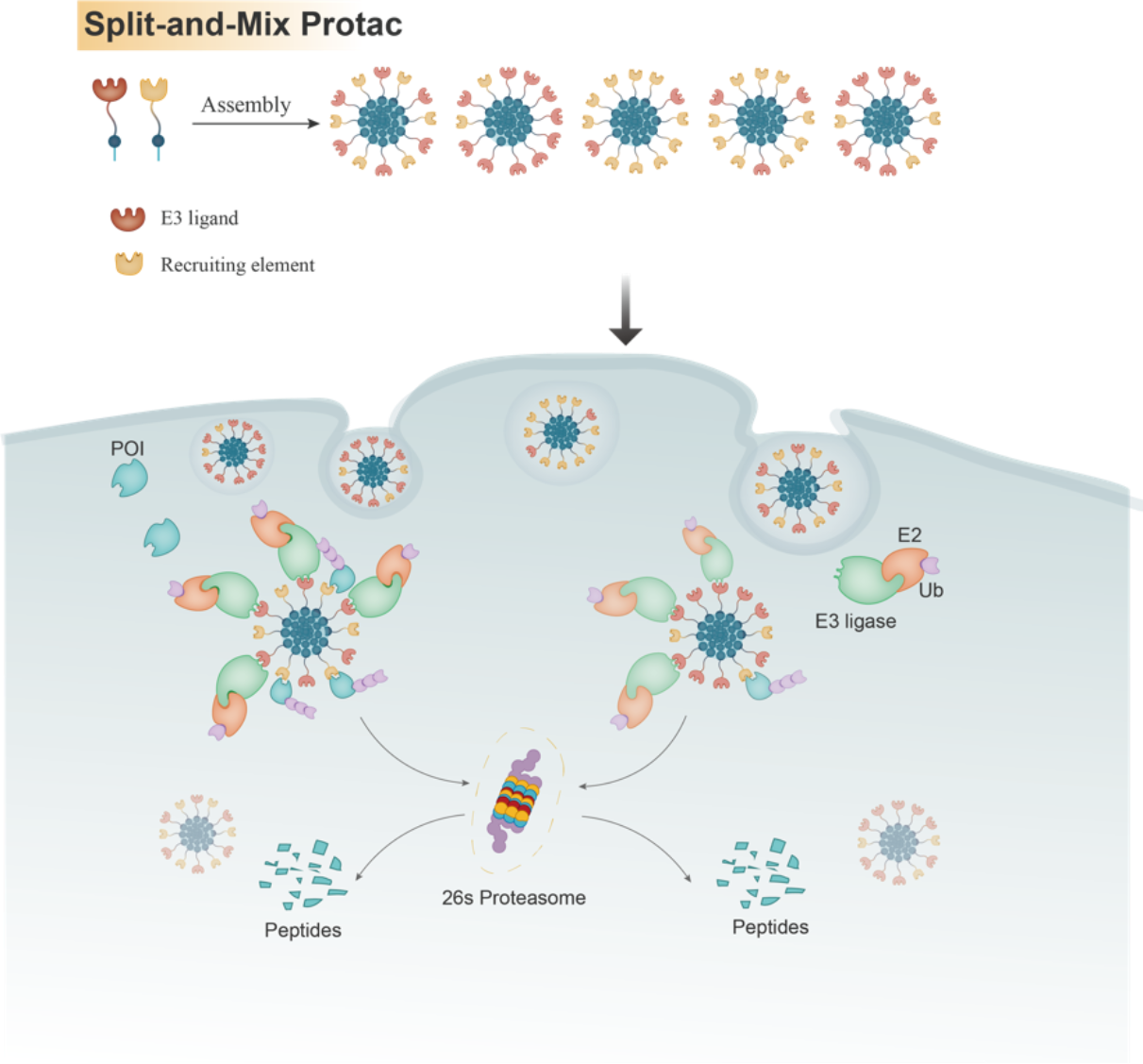
Split-and-Mix PROTAC概念图
作者在ERα和CDK4/6靶点中验证其降解活性、降解机制和可调比例能力,并在AR、EGFR、MEK1/2、BRD2/4和BCR-ABL等多个靶标上验证了SM-PROTAC平台的通用性。SM-PROTAC旨在作为一个PROTAC平台,为解决PROTAC药物开发中遇到的一些挑战提供新的解决思路,比如其可以快速并且有效地筛选靶标蛋白配体、快速筛选E3泛素连接酶配体、扩大PROTAC中E3泛素连接酶的可使用范围,并且可以帮助合理化设计传统的小分子PROTAC。
总之,这项研究通过将分合纳米平台和多肽自组装技术应用于PROTAC技术中,成功开发了一种新型的药物研发平台SM-PROTAC,它具有高效、可靠、节省时间等优点,在药物研发领域具有广阔的应用前景。分合(Split-and-Mix)纳米平台概念可以应用于其他降解剂体系,如LYTAC、AUTAC、RIBOTAC,形成SM-LYTAC、SM-AUTAC、SM-RIBOAC等。SM-PROTAC的成功开发对药物研发具有重要意义,为药物研发提供了一种新的思路。
该工作由北京大学深圳研究生院李子刚/尹丰课题组研究生阳芬芳和深圳市第二人民医院药学部的罗钦宏博士共同完成,为本文作出贡献还有王玥琛、梁慧婷、王亚琪、侯占峰等人。以上工作得到了国家自然科学基金、广东省自然科学基金、深圳市科技创新委员会等基金的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


