Nat Commun:揭示机体癌症干细胞扩散且对疗法耐受背后的分子机制
来源:生物谷原创 2024-06-15 10:08
本文研究结果表明,在多种癌症中,旁分泌信号通路或许会被E2F-GCN5-RB轴所控制,而这或许有望作为一种清除机体癌症干细胞的潜在治疗性靶点。
癌症的致死率、化疗耐药性和转移特性与表型可塑性癌症干细胞(CSCs)有关,然而目前研究人员并不清楚非细胞自主信号通路和细胞自主转录及其如何调节癌症干细胞的干细胞样特性。近日,一篇发表在国际杂志Nature Communications上题为“The pRb/RBL2-E2F1/4-GCN5 axis regulates cancer stem cell formation and G0 phase entry/exit by paracrine mechanisms”的研究报告中,来自牛津大学等机构的科学家们通过研究识别出了一种能控制癌症干细胞形成和行为的关键轴,癌症干细胞是一类癌细胞亚群,其能影响癌症的致死性、对化疗的耐受性以及其在机体其它部位的扩散能力;相关研究结果或能为科学家们开发新型更有效的癌症疗法提供新的思路和希望。
文章中,研究人员重点关注理解细胞自主(细胞内独立于细胞外信号发挥作用的机制)和非细胞自主(来自细胞外的外部信号)通路之间复杂的相互作用,这些通路能在胰腺癌中控制癌症干细胞的干细胞样行为。癌症干细胞存在于多种人类癌症中,包括脑癌、乳腺癌、结肠癌、食管癌、肝癌、肺癌、卵巢癌、前列腺癌、胃癌和甲状腺癌中。
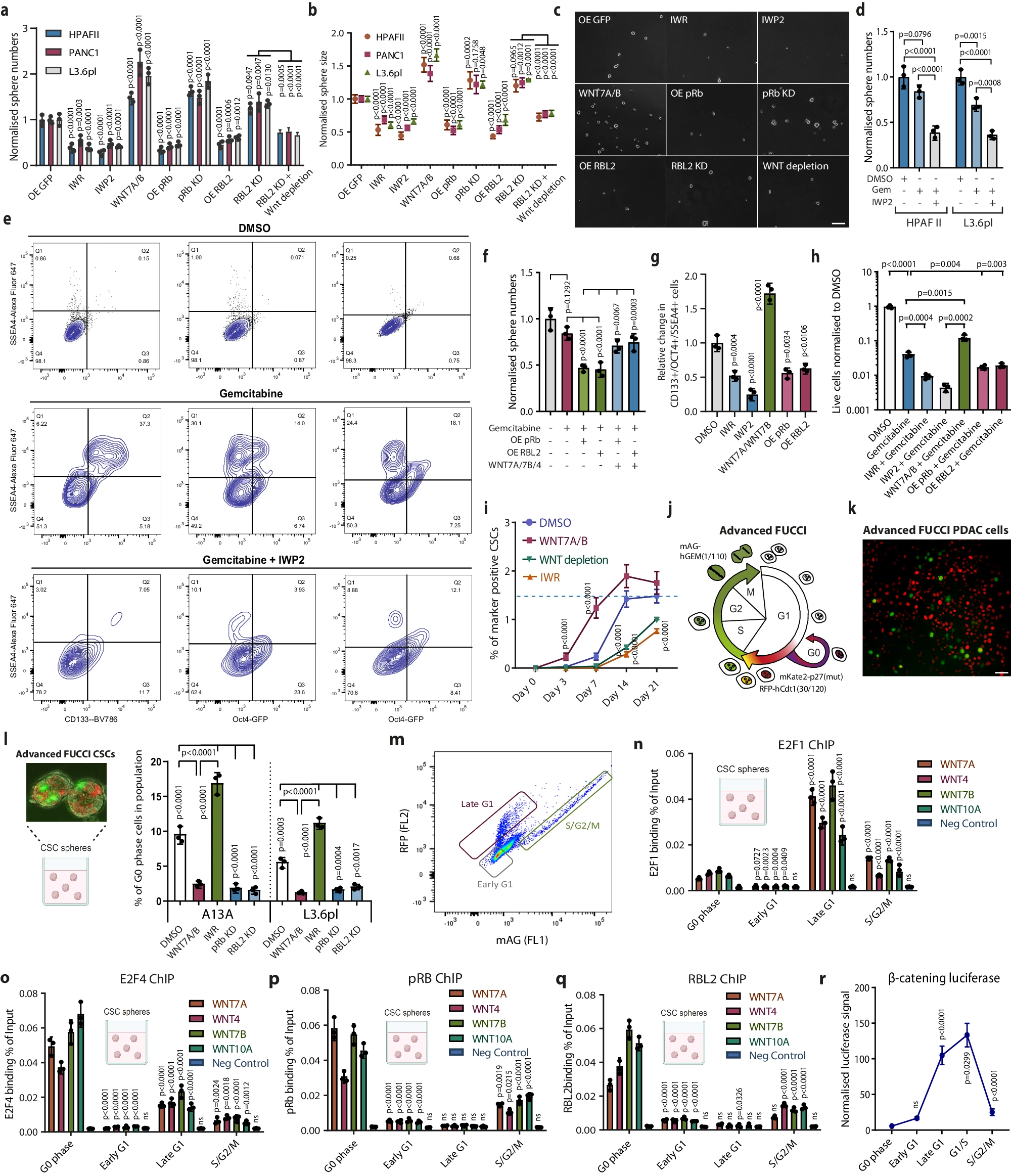
揭示机体癌症干细胞扩散且对疗法耐受背后的分子机制
图片来源:Nature Communications (2024). DOI:10.1038/s41467-024-47680-z
利用一种定量蛋白质组方法来分析胰腺癌干细胞中细胞外空间(分泌组,secretome)的一组蛋白质,研究人员揭示了涉及视网膜母细胞瘤(RB)蛋白和E2F转录因子的复杂轴如何控制促进癌症干细胞行为和化疗耐受性的信号分子的产生。研究者Siim博士说道,我们惊讶地发现,众所周知的细胞周期调节子pRb和E2F(此前被认为仅具有细胞自主效应)实际上在控制关键达到WNT配体的分泌上也扮演着一种非细胞自主性角色,WNT配体能驱动癌症干细胞的干细胞样特性,这一研究或能为允许癌症干细胞生存并躲避疗法的非细胞自主性机制提供重要的研究见解。
研究者发现,E2F1和E2F4转录因子能诱导诸如WNT7A、WNT7B、WNT10A和WNT4等WNT配体的表达,同时pRb和RBL2蛋白也能发挥作用从而降低其自身表达;这种微妙的平衡会在携带KRAS突变的癌细胞中被打断,从而引起癌症干细胞中这些WNT配体的异常分泌以及WNT/β-连环蛋白信号通路的激活。研究者Siim说道,细胞自主转录调节子和非细胞自主性信号通路之间的相互作用是癌症干细胞生物学研究中的一个重要方面,但其常常会被忽视,本文研究强调了靶向作用这些细胞外交流网络从而有效消除这种可塑细胞群的重要性。
本文研究所提出的新见解或为开发更有效的癌症疗法铺平了道路,因为靶向作用已经识别的通路或许能潜在破坏癌症干细胞的自我更新、化疗耐受和转移特性,这通常是癌症患者治疗失败和疾病复发的原因。综上,本文研究结果表明,在多种癌症中,旁分泌信号通路或许会被E2F-GCN5-RB轴所控制,而这或许有望作为一种清除机体癌症干细胞的潜在治疗性靶点。(生物谷Bioon.com)
参考文献:
Chang, CH., Liu, F., Militi, S. et al. The pRb/RBL2-E2F1/4-GCN5 axis regulates cancer stem cell formation and G0 phase entry/exit by paracrine mechanisms. Nat Commun 15, 3580 (2024). doi:10.1038/s41467-024-47680-z
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


