Nature | 从胚胎发育到病理状态:铁死亡如何协调大规模细胞死亡
来源:生物世界 2024-07-18 13:57
通过对铁死亡的研究,该研究揭示了其通过触发波在长距离内传播的机制,强调了ROS反馈环路在这一过程中起关键作用。
大规模细胞死亡通常发生在有机体发育和人类病理过程中。这些细胞死亡事件在空间和时间上是如何协调的仍是一个未解之谜。触发波(trigger waves)是一种长距离信号传递的机制,但这种机制如何用于细胞群体中的死亡事件仍不清楚。7月10日Nature的研究报道“Emergence of large-scale cell death through ferroptotic trigger waves”,展示了铁死亡(ferroptosis),一种依赖于铁和脂质过氧化的细胞死亡形式,可以通过活性氧(reactive oxygen species,ROS)触发波在长距离(≥5毫米)内以恒定速度(约5.5微米/分钟)传播。
化学和遗传干扰实验表明,ROS反馈环路(如Fenton反应、NADPH氧化酶信号传导和谷胱甘肽合成)在铁死亡触发波的进程中起主要作用。通过抑制胱氨酸(cystine)摄取引入铁死亡应激,可以激活这些ROS反馈环路,将细胞的氧化还原系统从单稳态(monostable)转换为双稳态(bistable),从而使细胞群体成为ROS传播的双稳态介质。此外,该研究还展示了在胚胎鸡肢体的肌肉重塑过程中,铁死亡及其传播伴随着大规模但空间上受限的细胞死亡事件,这表明铁死亡在胚胎发育期间可作为一种组织塑造策略。该研究揭示了铁死亡在协调全球细胞死亡事件中的作用,提供了一种研究胚胎发育和人类病理中大规模细胞死亡的新范式。
在胚胎发育和疾病过程中,大规模细胞死亡是一种常见现象。在胚胎发生过程中,大规模细胞死亡作为一种组织塑造过程,形成器官所需的腔和管。在病理条件下,如缺血再灌注和退行性疾病,过度的组织损伤也会导致大规模细胞死亡。这些细胞死亡事件通常在组织中连续发生,消除大群细胞。虽然已知细胞死亡事件可以通过扩散信号(如细胞毒性分子和ROS)影响邻近细胞,但这些旁观者效应在空间和时间上很快被削弱,限制了细胞死亡的范围(约20微米或2-3个细胞)。因此,如何通过简单扩散克服局部和短暂的死亡信号引发的空间限制,从而引起全面的细胞死亡事件仍不清楚。
集体细胞死亡需要强大的信号传递机制,这通过触发波的机制得以实现。与简单扩散不同,触发波可以在长距离内传播而不降低速度或振幅。触发波在自然界中无处不在,如神经元放电、蛙卵中的有丝分裂和凋亡波以及传染病流行。尽管它们在分子细节上有所不同,但所有这些例子都依赖于可激发或双稳态介质,在这些介质中信号得以再生和传递。考虑到大规模细胞死亡的普遍性,研究人员推测人类细胞可以被诱导成为双稳态细胞群体,允许通过触发波传播死亡信号。
该研究通过展示铁死亡如何作为触发波在细胞间传播,为大规模细胞死亡的研究提供了新的视角,同时也揭示了铁死亡在胚胎发育和疾病中的重要作用。这些发现不仅有助于理解细胞死亡的基本机制,还为开发新的治疗策略提供了潜在的靶点。
在胚胎发育过程中,大规模细胞死亡作为一种组织塑造过程,形成器官所需的腔和管。在病理条件下,如缺血再灌注(ischaemia-reperfusion)和退行性疾病(degenerative diseases),过度的组织损伤也会导致大规模细胞死亡。这些细胞死亡事件通常在组织中连续发生,消除大群细胞。已知细胞死亡事件可以通过扩散信号(如细胞毒性分子和ROS)影响邻近细胞,但这些旁观者效应在空间和时间上很快被削弱,限制了细胞死亡的范围。因此,如何通过简单扩散克服局部和短暂的死亡信号引发的空间限制,从而引起全面的细胞死亡事件仍不清楚。
研究团队使用人类视网膜色素上皮细胞(retinal pigment epithelial cells, RPE)作为模型细胞系。通过抑制胱氨酸(cystine)摄取或使用铁死亡诱导剂(如erastin和RSL3)引发铁死亡。为了研究铁死亡触发波的传播机制,细胞被处理后进行一系列实验,包括化学和遗传干扰实验,以确定ROS反馈环路(如Fenton反应、NADPH氧化酶信号传导和谷胱甘肽合成)在铁死亡触发波进程中的作用。
利用RPE细胞对蓝光(blue-light)的敏感性,通过蓝光照射引入外源性ROS,控制铁死亡的时间和位置。实验中,通过蓝光照射处理过的RPE细胞,观察铁死亡从光照区域向外传播的情况。使用核染料荧光图像和时间序列图像记录细胞死亡的传播过程,并通过kymograph分析铁死亡传播的速度和规律性。
使用荧光显微镜和各种染料(如C11-BODIPY581/591和CellROX深红)对细胞死亡和脂质过氧化进行实时监测和定量分析。研究人员通过这些技术,精确测量了铁死亡传播的速度、范围和特征。此外,通过使用不同的化学抑制剂(如DFO和铁补充剂),进一步验证了铁死亡传播过程中ROS和铁的关键作用。
为了验证铁死亡在胚胎发育中的作用,研究团队使用了胚胎鸡肢体模型。通过全胚染色和TUNEL染色,研究人员观察和记录了胚胎鸡肢体在不同发育阶段的细胞死亡情况,尤其是肌肉重塑过程中发生的细胞死亡。研究团队还进行了免疫荧光染色,以检测脂质过氧化标志物(如4-HNE)在不同组织中的分布和变化。
铁死亡的传播特性
研究发现,铁死亡可以通过ROS触发波在长距离内传播,传播速度约为5.5微米/分钟。通过对16种不同的人类细胞系进行实验,发现铁死亡传播表现出高度的时空有序性。具体而言,铁死亡的传播速度和范围在抑制GPX4的细胞系中明显受到影响,而在抑制胱氨酸摄取的情况下,铁死亡的传播更为显著。这表明铁死亡的传播特性在很大程度上取决于其诱导机制。
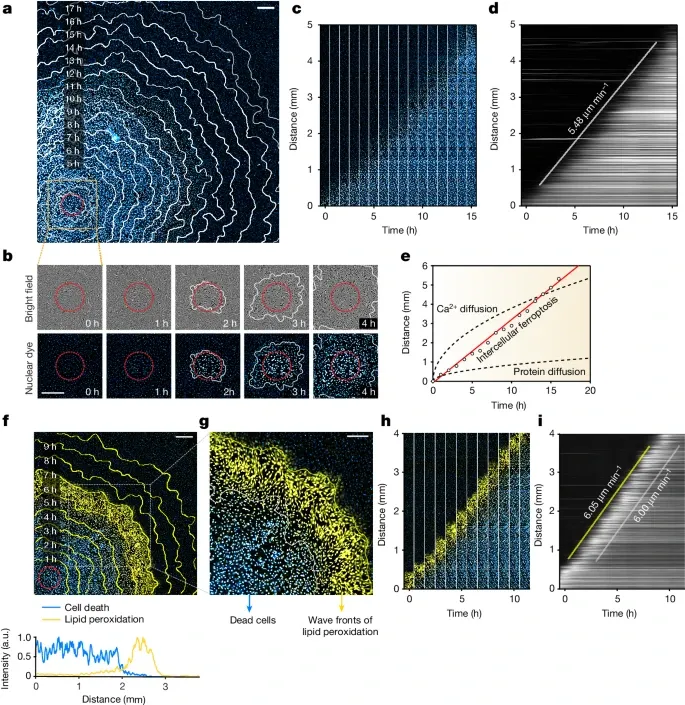
铁死亡如何在RPE-1细胞中通过脂质过氧化波前以恒定速度传播(Credit: Nature)
图a:核染料荧光图像 在蓝光光诱导后11小时,处理过的RPE-1细胞中的铁死亡传播情况。红色圆圈表示光诱导区域,而白色轮廓线表示不同时间点的细胞死亡边界。通过核染料(如SYTOX Green)荧光标记,可以清晰地看到细胞死亡的传播路径。
图b:时间序列图像 光诱导后18小时内,铁死亡在RPE-1细胞中的传播过程。每张图像对应不同的时间点,展示了从光诱导区域向外扩展的细胞死亡波前。细胞死亡通过细胞破裂和核染料荧光强度增加来指示。
图c:时间序列图像数组 对图a和图b中数据的进一步处理。通过将不同时间点的图像排列在一起,可以直观地看到铁死亡传播的时间进程。每个图像都显示了特定时间点的细胞死亡状态。
图d:铁死亡传播的Kymograph图 铁死亡传播的Kymograph分析结果,白色线条表示核染料荧光前沿的线性最小二乘拟合,其斜率代表传播速度。研究发现,铁死亡的传播速度约为5.5微米/分钟,并且在长距离(≥5毫米)内保持恒定。
图e:不同分子传播的比较 比较了铁死亡传播与钙离子(Ca2+)和蛋白质扩散的传播距离和时间关系。结果显示,铁死亡传播呈线性关系,支持铁死亡通过触发波而非简单扩散的观点。
图f和图g:脂质过氧化波前 脂质过氧化(使用C11-BODIPY581/591染料)在细胞死亡之前的传播情况。黄色轮廓线表示不同时间点的脂质过氧化边界。图f展示了光诱导后7小时的图像叠加,而图1g展示了放大后的区域图像。
图h和图i:脂质过氧化传播的时间序列图像数组和Kymograph图 图h展示了脂质过氧化和细胞死亡的时间序列图像数组,图i展示了相应的Kymograph图。黄色和白色线条分别代表脂质过氧化和细胞死亡传播的速度,结果显示二者的传播速度相似,约为6.05微米/分钟。
ROS反馈环路的作用
化学干扰实验显示,铁死亡触发波的进程主要由ROS反馈环路控制。通过使用铁螯合剂DFO和铁补充剂,研究人员发现细胞内可移动铁水平在铁死亡传播中起关键作用。具体而言,DFO处理(80微摩尔)显著减慢了铁死亡的传播速度,而铁补充剂(250微摩尔)则加速了铁死亡的传播速度。此外,实验还发现,通过抑制NADPH氧化酶和PI3K信号传导,铁死亡的传播速度也会减慢。这些结果表明,Fenton反应、NADPH氧化酶信号传导和谷胱甘肽合成在铁死亡传播过程中起重要作用。
铁死亡在胚胎发育中的作用
在胚胎鸡肢体模型中,研究团队观察到铁死亡在肌肉重塑过程中扮演了重要角色。通过全胚染色和TUNEL染色,发现铁死亡主要发生在肌肉层和肢体的背腹外胚层,尤其是中轴区域。这些区域的细胞呈现出高度的脂质过氧化,表明铁死亡的波动性传播是大规模细胞死亡的主要机制。此外,通过免疫荧光染色,研究人员还观察到4-HNE标志物在这些区域的显著表达,进一步证实了铁死亡在胚胎发育过程中的关键作用。
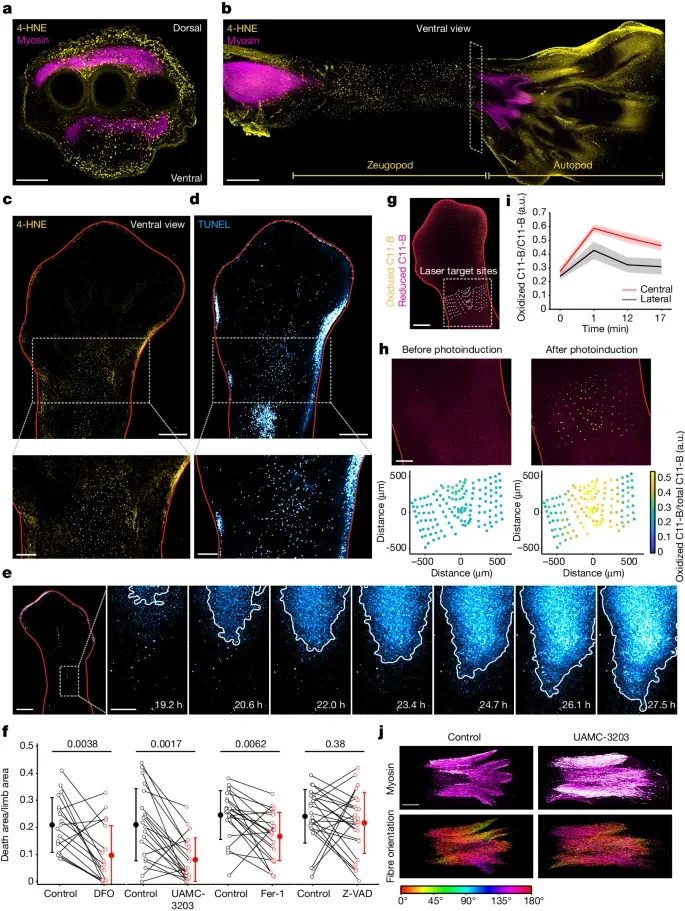
铁死亡及其传播如何促进鸟类肢体的肌肉重塑(Credit: Nature)
图a和图b:4-HNE和肌球蛋白重链的共免疫染色 在胚胎发育过程中不同阶段的肢体横截面和纵截面的4-HNE(一种脂质过氧化标志物)和肌球蛋白重链的共免疫染色结果。图a展示了肢体zeugopod(前臂部分)的横截面,显示出4-HNE和肌球蛋白重链的分布。图b展示了肢体背腹外胚层的纵截面,显示出脂质过氧化主要集中在近端-远端轴上的区域。
图c和图d:4-HNE和TUNEL染色的整体染色结果 胚胎发育阶段(HH32)肢体的整体染色结果。图c显示了4-HNE的分布情况,而图d展示了TUNEL染色(细胞凋亡标志物)的分布情况。结果表明,脂质过氧化和细胞死亡主要集中在肢体zeugopod的中央区域。
图e:细胞死亡的时间序列图像 在光诱导后不同时间点的细胞死亡情况。通过核染料荧光图像记录了从近端到远端区域的细胞死亡传播过程。研究发现,细胞死亡以约1.15微米/分钟的速度传播。
图f:不同抑制剂对细胞死亡面积的影响 不同铁死亡抑制剂(如UAMC-3203、DFO和Fer-1)和凋亡抑制剂(Z-VAD-FMK)对细胞死亡面积的影响。结果显示,铁死亡抑制剂显著减少了肢体zeugopod的细胞死亡面积,而凋亡抑制剂则没有显著影响。
图g和图h:PALP实验 使用光化学活化膜脂质过氧化(PALP)技术测量肢体不同区域脂质过氧化水平的结果。图5g展示了用激光脉冲靶向的肢体图像,而图h展示了目标区域的放大图像。结果显示,中轴区域的脂质过氧化水平显著高于侧翼区域。
图i:中心和侧翼区域的脂质过氧化水平比较 比较了肢体zeugopod中中心区域和侧翼区域的脂质过氧化水平。结果表明,中心区域的脂质过氧化水平显著高于侧翼区域,这支持了中轴区域是铁死亡传播的主要区域。
图j:肌肉纤维染色 UAMC-3203处理和对照处理的胚胎(HH33阶段)的肌肉纤维染色结果。结果显示,未处理的胚胎在前-后轴上有清晰的肌肉分离,而抑制铁死亡的处理导致了过多的肌肉纤维和肌肉分离不良。
铁死亡作为一种新型的细胞死亡形式,其传播特性和调控机制在胚胎发育和疾病病理中具有重要意义。触发波机制允许铁死亡信号在长距离内传播,而不受简单扩散的空间限制。这一发现不仅揭示了铁死亡在协调大规模细胞死亡事件中的作用,还为开发新的治疗策略提供了潜在的靶点。例如,通过调控ROS反馈环路,可以控制铁死亡的传播速度和范围,从而在治疗缺血再灌注损伤和退行性疾病中发挥作用。
铁死亡与其他细胞死亡形式的比较
铁死亡与细胞凋亡(apoptosis)和坏死(necrosis)等其他细胞死亡形式在机制上有所不同。细胞凋亡是一种程序性细胞死亡,主要通过细胞内信号传导途径引发,而坏死则是一种非程序性的细胞死亡,通常由外部损伤引起。相比之下,铁死亡依赖于铁和脂质过氧化,具有独特的生化特性和调控机制。
铁死亡在癌症治疗中的潜力
铁死亡在癌症治疗中显示出潜在的应用前景。某些癌细胞对铁死亡具有高度敏感性,通过诱导铁死亡可以有效杀死这些细胞。此外,铁死亡还可以克服某些癌细胞对传统治疗方法的耐药性。因此,研究如何有效诱导铁死亡,可能为癌症治疗提供新的策略。
ROS在细胞信号传导中的作用
ROS在细胞信号传导中发挥重要作用,参与调控多种细胞过程,如增殖、分化和死亡。在铁死亡过程中,ROS通过反馈环路放大并传播信号,导致大规模细胞死亡。深入研究ROS的信号传导机制,有助于揭示细胞死亡的调控网络,并开发基于ROS调控的治疗方法。
通过对铁死亡的研究,该研究揭示了其通过触发波在长距离内传播的机制,强调了ROS反馈环路在这一过程中起关键作用。这一发现不仅拓展了我们对细胞死亡机制的理解,还为研究胚胎发育和人类病理中的大规模细胞死亡事件提供了新视角。未来的研究可以进一步探讨铁死亡在其他生理和病理过程中的作用,并开发基于这一机制的新的治疗策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


