髓过氧化物酶的多种作用:从炎症和免疫到生物标志物、药物代谢和药物发现
来源:本站原创 2021-09-08 09:46
这篇综述为髓过氧化物酶(MPO)提供了实用指南,并介绍了它在生物学中的存在的多样性。本文提供了历史背景,从过氧化物酶的活性到MPO的发现,再到它在疾病和药物开发中的作用。
这篇综述为髓过氧化物酶(MPO)提供了实用指南,并介绍了它在生物学中的存在的多样性。本文提供了历史背景,从过氧化物酶的活性到MPO的发现,再到它在疾病和药物开发中的作用。本文讨论了MPO的必要性,因为特定的个体缺乏MPO表达。贯穿始终的一个潜在主题提出了MPO活动的利益和负担问题。讨论了酶的结构,包括精确的质量和糖基化位点。介绍了MPO的催化循环及其相应的途径,并讨论了不同状态的MPO氧化还原偶对的重要性。
图片来源:https://doi.org/10.1016/j.redox.2021.102109
髓过氧化物酶(MPO)的最初鉴定是通过化学反应的经验观察得来的。下面的观察是由原文章总结出来的。MPO的发现源于对愈创木酊剂(愈创木和酒精的混合物)在脓液中变色的观察。后来其他人发现这种颜色变化发生在白细胞和骨髓中。此外,MPO的过氧化物酶性质反映在Nadi试剂(一种N,N-二甲基-对苯基二胺和1-萘酚的混合物,氧化所需的H2O2。最后,过氧化氢酶降解H2O2,也阻止了靛酚蓝的形成。它的绿色和过氧化物酶的活性使这种酶获得了绿色过氧化物酶的称号。1941年,谢尔·艾格纳发现了这种酶。
Nauseef还提供了一个很好的历史背景,包括Agner的研究是他医学院博士论文的一部分。然而,这种酶的名字,绿过氧化物酶,并没有经受住时间的考验,直到1980年大约有9篇文章使用了这个命名法。这可能避免了未来的混淆,因为血管过氧化物酶(VPO)是在2008年发现的。
MPO是从人类急性髓系白血病细胞中克隆出来的,这表明一个单一的基因负责其编码。MPO位于17号染色体上。Morishita等人的研究报道,人MPO基因由12个外显子和11个内含子组成,位于17q23.1带。此外,还发现了一个单一的mRNA转录起始位点,与原癌基因c-myc的5 -启动子区序列同源。在小鼠或人早幼粒细胞白血病细胞分化为粒细胞或单核细胞的过程中,已经观察到MPO和c-myc的mRNA均在粒细胞集落刺激因子的作用下下降。有趣的是,其他相关过氧化物酶,包括嗜酸性粒细胞过氧化物酶、乳过氧化物酶和甲状腺过氧化物酶,似乎聚集在同一个区域,嗜酸性粒细胞过氧化物酶位于MPO和乳过氧化物酶基因的34 kb处。
MPO蛋白是四聚体,估计总分子量为150,000
kDa。四聚体由两个半(hemiMPO)组成,由两个重(~60
kDa)和两个轻(~15 kDa)组分组成。以前报道的分子量范围为120 000 ~ 160 000 kDa。据报道,人类MPO大链中有467个氨基酸,短链中有105个氨基酸。
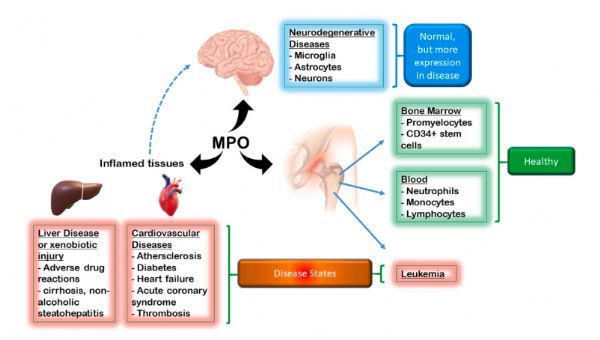
MPO作为疾病状态的生物标志物的有效性。
图片来源:https://doi.org/10.1016/j.redox.2021.102109
MPO在其健康和疾病的功能谱上具有显著的多样性。在阅读了这篇综述后,考虑到临床MPO抑制剂正在被评估,人们可能会想,没有这种酶我们可能会更好。然而,这是过分简单化的,因为健康的国际环境必须实现与MPO的正常存在和活动。事实上,考虑到大多数个体MPO的表达展现出一种基本的(保护性)功能,也许对过度活跃的MPO进行调控更为可取。当疾病和病理生物学开始发挥作用时,MPO抑制成为一个可行的目标,尽管临床试验将确切地告诉我们这是如何实现的。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。