Nature:孙杰团队揭示免疫-上皮祖细胞异常生态位在病毒性肺部后遗症中的关键作用
来源:生物探索 2024-09-06 12:13
该研究揭示了在病毒性肺炎后遗症(特别是PASC)中,免疫系统与上皮祖细胞之间的异常互动是驱动纤维化的关键机制。
弗吉尼亚大学医学院孙杰 (Jie Sun)、臧充之 (Chongzhi Zang)联合Cedars-Sinai医疗中心Peter Chen在Nature杂志上发表了题为An aberrant immune-epithelial progenitor niche drives viral lung sequelae的研究工作。该研究通过系统分析PASC患者的肺组织样本,结合小鼠模型,揭示了在PASC中,免疫系统与上皮祖细胞之间的异常相互作用是推动肺纤维化形成的关键因素。

研究团队对来自三个PASC患者队列的肺组织样本进行了深入的空间转录组学分析,并结合高分辨率成像技术,首次系统性地揭示了在PASC中,肺内驻留的CD8+ T细胞和巨噬细胞之间的相互作用如何导致纤维化的发生。具体而言,研究发现CD8+ T细胞在急性感染后期持续存在于肺组织中,并通过释放高水平的IFN-γ和TNF,活化了局部巨噬细胞。这些被激活的巨噬细胞随后持续释放IL-1β,这种炎症级联反应在局部形成了一个异常的免疫-上皮祖细胞生态位,阻碍正常的肺泡再生过程,并最终导致纤维化的发生。
为了验证在人类样本中发现的这些机制,研究团队比较了SARS-CoV-2感染不同小鼠品系以及PR8感染的模型,旨在找出最接近人类PASC病理特征的模型。实验结果表明,虽然SARS-CoV-2感染可以引发明显的急性炎症反应,但在多数小鼠品系中未能复制人类PASC的长期病理特征。相比之下,PR8(H1N1流感病毒株)感染的老年鼠展示出了与人类PASC患者更为相似的病理特征,包括明显的纤维化和异常的免疫-上皮祖细胞生态位形成。特别地,在PR8感染的老年鼠中,团队观察到了与人类PASC肺组织高度一致的转录组学变化。此外,这些小鼠的肺泡结构损伤严重,表现出类似于PASC患者的纤维化特征,进一步证明了PR8感染模型的临床相关性和实验结果的适用性。
基于此,研究团队对老年鼠在病毒感染中的特异性免疫反应进行了深入分析。与年轻小鼠相比,老年鼠的CD8+ T细胞表现出更持久且强烈的炎症反应,IFN-γ和TNF的表达水平更高且下调缓慢。这种持续的高水平炎症不仅促使巨噬细胞的长期激活,还导致纤维化相关基因的上调。而抗体删除CD8+ T细胞显著改善了老年鼠的肺泡再生能力,减轻了肺纤维化。这一发现确认了CD8+ T细胞在推动PASC相关纤维化过程中的重要作用。
随后,研究团队进一步探讨了炎症因子IFN-γ、TNF和IL-1β在纤维化进程中的具体作用。研究发现,中和抗体阻断IFN-γ和TNF信号显著减少巨噬细胞的激活,降低IL-1β的释放,从而减轻了纤维化的严重程度。直接中和IL-1β也显示出显著的效果。使用IL-1b中和抗体治疗的小鼠表现出纤维化进程的明显减缓,并恢复了肺泡上皮细胞的正常功能。组织学分析显示,治疗后的小鼠肺部纤维化区域显著减少,肺泡结构得以修复。这些结果支持了IL-1β在纤维化中的关键调控作用,并为临床干预提供了明确的治疗靶点。
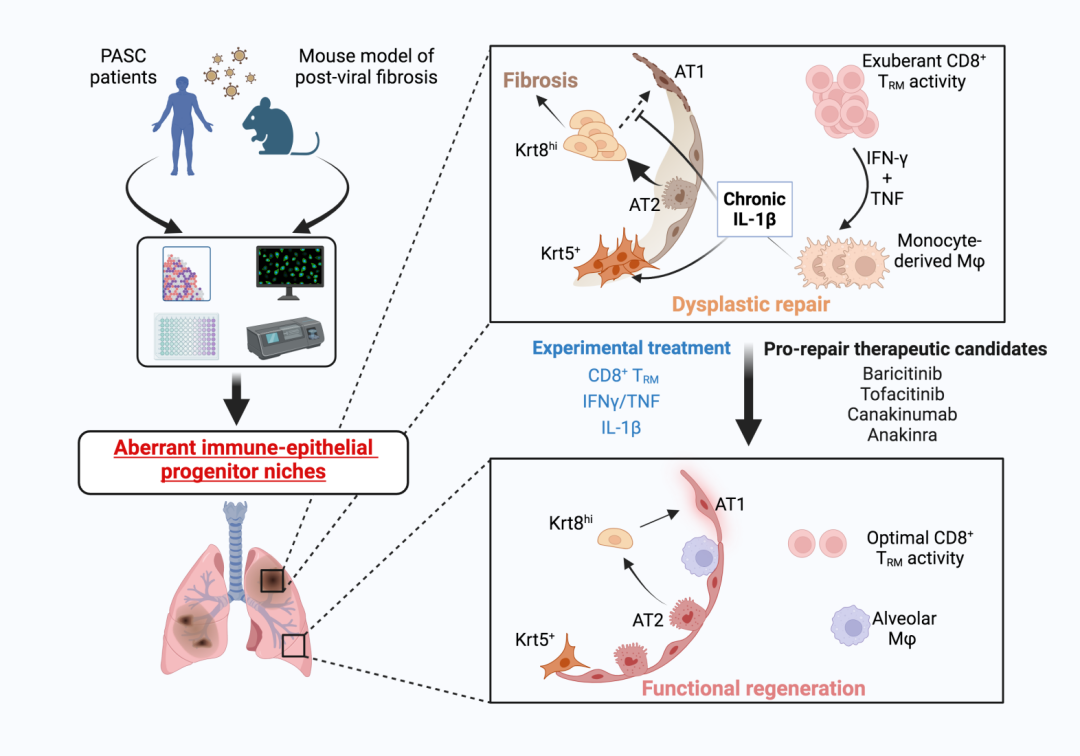
模式图(Credit: Nature)
该研究的重要意义在于揭示了在病毒性肺炎后遗症(特别是PASC)中,免疫系统与上皮祖细胞之间的异常互动是驱动纤维化的关键机制。这一发现不仅为理解PASC的病理生理学提供了新的视角,还为开发有效的治疗策略提供了坚实的基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


