JEM:新型组合性疗法有望治疗人类转移性卵巢癌
来源:生物谷原创 2024-12-26 10:22
基于这一概念,研究者Zhang等人设计了一种方法,其能通过结合β-葡聚糖(β-glucan,一种病原体所衍生的骨髓细胞激活剂)和干扰素γ(IFNγ)的疗法,从而就能特异性地激活腹腔中的骨髓细胞。
转移性卵巢癌(OvCa,metastatic ovarian cancer)患者的5年生存率低于30%,这是由于腹膜液中化疗耐药细胞的持续扩散和腹腔中免疫抑制微环境的建立所致。
近日,一篇发表在国际杂志Journal of Experimental Medicine上题为“Myeloid activation clears ascites and reveals IL27-dependent regression of metastatic ovarian cancer”的研究报告中,来自威斯塔研究所等机构的科学家们通过进行临床前实验室分析后发现了一种能治疗人类卵巢癌的新方法,这种方法能缩小机体的肿瘤并改善患者的生存率,同时还能促使肿瘤对化疗手段更有反应性。
研究者Zhang说道,这是研究人员首次在临床前模型中通过诱导免疫反应从而间接靶向作用腹膜液中的卵巢癌细胞,我们期待后期能进一步研究,尤其是揭示IL27的关键角色,以便我们能继续确定其它策略来改善新型抗卵巢癌的方法。卵巢癌是最致命的妇科癌症,转移性卵巢癌患者在确诊后其5年的存活率仅有30%,而卵巢癌转移的危险(当癌症扩散到全身时)也会加剧,主要有两方面原因:1)卵巢癌天然对化疗耐药,因此其在机体任何部位都很难被消灭;2)卵巢癌倾向于通过腹膜液来转移到腹腔中,而腹腔是机体中能容纳胃部和肠道的较大空间,腹腔中的癌症尤其危险,因为该区域具有天然的免疫抑制性,从而就限制了机体对任何肿瘤的反应。
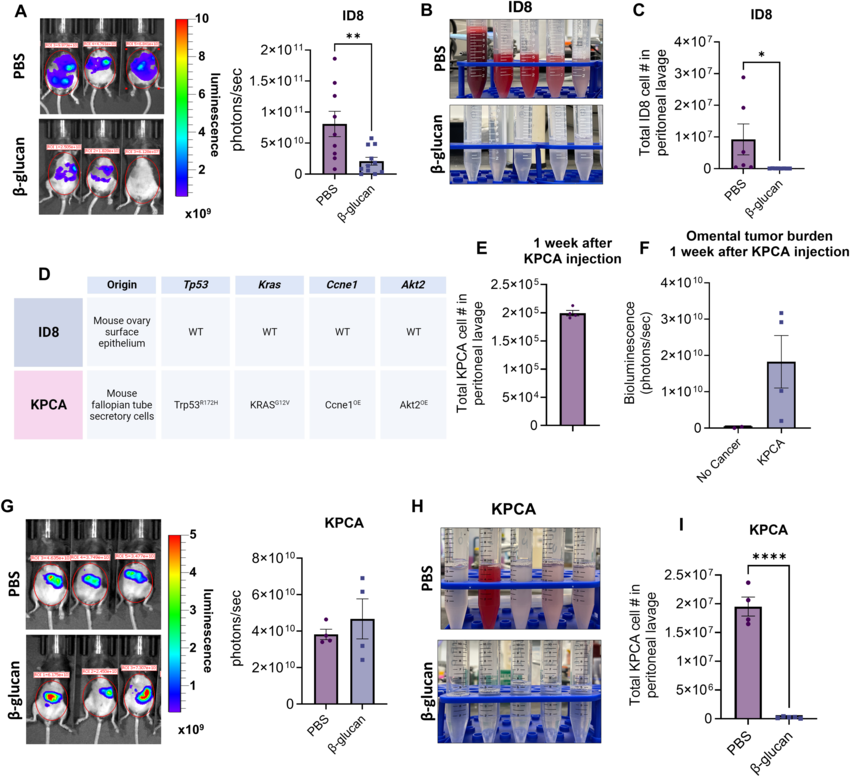
β-葡聚糖能显著降低转移性卵巢癌的液体肿瘤负担
为了对抗卵巢癌给人类健康带来的挑战,研究人员转向了近一个世纪以前的一种可能的解决方案,在19世纪末20世纪初期,纽约的外科医生William B. Coley通过向患者体内注射死亡的病原体实现了某些癌症10%以上的治愈率,后来科学家们推断,这种抗癌效应或许是机体免疫系统对骨髓细胞的激活所致,而且骨髓细胞是腹腔中存在的大量细胞,当其被激活时就能诱发杀灭癌细胞的反应。
基于这一概念,研究者Zhang等人设计了一种方法,其能通过结合β-葡聚糖(β-glucan,一种病原体所衍生的骨髓细胞激活剂)和干扰素γ(IFNγ)的疗法,从而就能特异性地激活腹腔中的骨髓细胞,初步研究报告表明,这种方法能有效逆转肿瘤周围的免疫抑制作用。当在临床前实验室模型中进行研究后,研究人员证实了这种组合性疗法能发挥作用,当利用β-葡聚糖和干扰素γ来治疗转移性卵巢癌模型后,肿瘤总负荷相较于对照显著缩小了,这种疾病的逆转甚至在化疗耐受的卵巢癌细胞中也是一致的,同时研究人员还进行了相关建模。
研究者Brennah Murphy博士说道,我们的研究为开发治疗一种尤其具有侵袭性的癌症的新型疗法打开了一扇大门,卵巢癌常常因其对疗法耐受而臭名昭著,但如今我们已经证明,在临床前的水平上,这种新型疗法或能克服卵巢癌的耐受性。综上,本文研究中,研究人员提出了一种新型治疗性策略来治疗人类转移性卵巢癌。(生物谷Bioon.com)
参考文献:
Brennah Murphy,Taito Miyamoto,Bryan S. Manning, et al. Myeloid activation clears ascites and reveals IL27-dependent regression of metastatic ovarian cancer, Journal of Experimental Medicine (2024). DOI:10.1084/jem.20231967
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


