JACS:科学家开发出或能靶向作用药物耐受性脑瘤的“变色龙化合物”
来源:生物谷原创 2024-06-07 13:41
来自耶鲁大学等机构的科学家们通过研究揭示了一种新型的化合物如何攻击药物耐受性脑瘤且不会损伤机体健康的周围组织。
异常的DNA修复是引发癌症发生的一大导火线,很多肿瘤都会表现出DNA修复能力下降,这或许就会促使其对基因毒素(genotoxins)变得敏感。近日,一篇发表在国际杂志Journal of the American Chemical Society上题为“Mechanism of Action of KL-50, a Candidate Imidazotetrazine for the Treatment of Drug-Resistant Brain Cancers”的研究报告中,来自耶鲁大学等机构的科学家们通过研究揭示了一种新型的化合物如何攻击药物耐受性脑瘤且不会损伤机体健康的周围组织,相关研究或许是科学家们开发所谓的“变色龙化合物”的关键一步,这种化合物有望用来靶向作用一系列人类恶性癌症。
每年大约都有2万名美国人被诊断为神经胶质瘤(glioma),其是一种大脑和脊髓发生的恶性肿瘤,在这些病例中,大约有1.3万例是胶质母细胞瘤,其是成年人中恶性脑瘤中最具侵袭性的脑瘤亚型。几十年来,胶质母细胞瘤患者一直利用称之为替莫唑胺(temozolomide)的药物来治疗,然而,大部分患者都会在治疗1年内对该药物产生耐受性,胶质母细胞瘤患者的5年生存率不到5%。早在2022年,研究人员就通过研究开发出了一种能更有效治疗胶质母细胞瘤的新型策略,他们开发出了一类名为变色龙化合物(chameleon compounds)的特殊抗癌分子,该分子能利用名为O6-甲基鸟嘌呤DNA甲基转移酶(MGMT)的DNA修复蛋白的缺陷发挥作用。
在很多癌细胞中(包括胶质母细胞瘤)MGMT蛋白处于缺失状态,这种新型的变色龙化合物就能被设计地损伤缺失MGMT的肿瘤细胞中的DNA的功能。这种变色龙化合物能通过在DNA上沉积初级损伤,并随着时间推移而进展为高度毒性的次级损伤(称之为链间交联,interstrand cross-links),从而开启DNA的损伤过程;MGMT能在病变转化为致死性链间交联之前通过修复初级损伤来保护健康组织中的DNA。
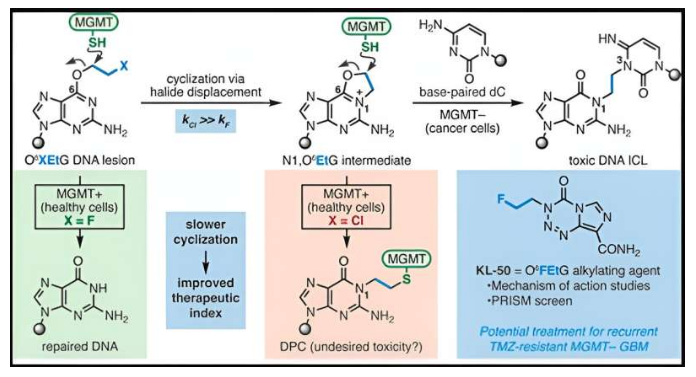
科学家开发出或能靶向作用药物耐受性脑瘤的“变色龙化合物”
图片来源:Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c06483
这项最新研究中,研究人员重点对名为KL-50的变色龙分子进行了相关研究。研究者Herzon博士说道,我们结合了合成化学和分子生物学研究来阐明我们早期观察结果的分子基础,以及产生这些化合物堵塞选择性的化学动力学特性;结果发现,KL-50的独特之处在于其能仅在DNA修复缺失的肿瘤中形成DNA的链间交联。研究者表示,这或许是一项本质的区别,许多其它抗癌化合物已经都被开发出来用来诱导链间交联,但其对于肿瘤细胞并没有选择性,这或许就会限制其功效。
KL-50成功的奥秘在于其作用时机,其产生链间交联的速度要比其它交联慢一些,这种延迟或许就会给予健康细胞足够的时间利用MGMT来预防交联再次发生。Bindra博士表示,这种独特的特征或许就揭示了其在治疗药物耐受性胶质母细胞瘤中的潜力,而这是目前临床上患者需求尚未得到满足的一个研究领域。更广泛地来讲,这项研究强调了考虑化学DNA修饰和生化DNA修复速率的重要性;研究人员或许就能利用这一策略来开发新型疗法治疗携带特异性肿瘤相关DNA修复缺失的其它癌症。
综上,本文研究结果表明,仔细考虑化学DNA修饰和生化DNA修复的速率或许有望帮助识别出其它肿瘤特异性的基因毒性制剂。(生物谷Bioon.com)
参考文献:
Eric D. Huseman,Anna Lo,Olga Fedorova, et al. Mechanism of Action of KL-50, a Candidate Imidazotetrazine for the Treatment of Drug-Resistant Brain Cancers, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c06483
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


