Nat Metab | 郭保生/蒋青/石云发现骨细胞衍生的硬化蛋白在衰老和阿尔茨海默病进展过程中损害认知功能
来源:生物世界 2024-03-01 13:00
该研究发现骨细胞来源的硬化蛋白可以在衰老和AD进展过程中通过与LRP6受体结合介导脑内Wnt -β-catenin通路的功能障碍。
南京大学郭保生、蒋青及石云共同通讯在Nature Metabolism在线发表题为“Osteocyte-derived sclerostin impairs cognitive function during ageing and Alzheimer’s disease progression”的研究论文,该研究发现骨细胞来源的硬化蛋白可以穿过老年小鼠的血脑屏障,在那里它可以失调Wnt -β-catenin信号传导。
功能获得和功能丧失实验表明,骨细胞来源的硬化蛋白异常升高会损害老年小鼠的突触可塑性和记忆。从机制上讲,硬化蛋白通过β-连环蛋白- β-分泌酶1 (BACE1)信号传导增加β淀粉样蛋白(Aβ)的产生,表明硬化蛋白在AD中的功能作用。因此,男女AD患者的高硬化蛋白水平与严重的认知障碍有关,这与骨质特异性过表达硬化蛋白的AD小鼠模型中Αβ生成加速一致。该研究证明了骨细胞衍生的硬化蛋白介导的骨脑串扰可以作为开发针对AD的治疗干预措施的靶点。

衰老加速认知障碍,增加对神经退行性疾病的易感性,特别是阿尔茨海默病(AD)。在衰老过程中,神经发生能力、突触强度和功能都会降低,然而衰老是如何导致这些神经病理表现的仍是一个谜。尽管大脑中许多与年龄相关的变化可能是大脑局部衰老机制的结果,但大脑或血浆内分泌系统的变化是否能揭示大脑衰老和认知障碍的某些方面仍不清楚。事实上,脑脊液中神经内分泌因子的这种变化与衰老和疾病有关;然而,其他器官分泌的因子,包括肝脏、肌肉和肠道等,也会影响海马功能。
越来越多的证据表明,骨骼除了支撑身体、保护软组织和促进运动外,还可以作为一种新的内分泌器官。骨可以分泌多种因子,包括骨钙素(OCN)、成纤维细胞生长因子23 (FGF23)和骨保护素(OPG),它们也被统称为骨因子,调节骨外器官的稳态。特别是,一些骨因子,包括OCN和脂载蛋白2 (LCN2),具有神经系统调节作用,包括海马发育和食欲。然而,骨因子是否介导衰老和AD进展过程中的脑功能障碍尚未得到很好的探讨。
硬化蛋白(Sclerostin)是Wnt -β-catenin通路的拮抗剂,主要由成熟骨细胞分泌,调节骨代谢。先前的研究表明,血清中高水平的硬化蛋白存在于各种疾病中,如2型糖尿病、肝病、肾脏疾病和骨关节炎,这表明升高的硬化蛋白水平对骨外器官有代谢失调的影响。有趣的是,血清硬化蛋白可以作为衰老的标志,因为它的水平随着年龄的增长而逐渐增加。因此,从逻辑上讲,有必要探讨血清硬化蛋白水平升高是否会影响脑功能,并在衰老甚至AD进展过程中导致认知能力下降。
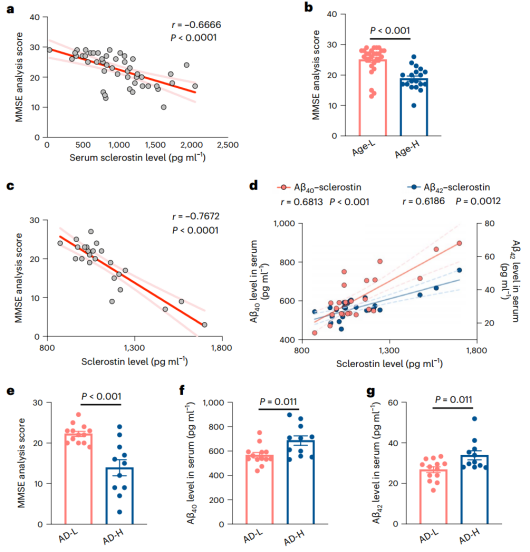
血清硬化蛋白升高与老年和AD患者的认知障碍相关(Credit: Nature Metabolism)
众所周知,硬化蛋白可以结合LRP5/6受体,随后抑制参与骨代谢的Wnt -β-catenin通路。有趣的是,Wnt -β-catenin信号传导在成人大脑的各种神经系统过程中也起着至关重要的作用,包括树突发生、突触可塑性和记忆。先前的证据表明,Wnt -β-catenin信号在衰老和AD进展过程中减少,而激活神经元中的Wnt -β-catenin通路可以改善这种发病机制中的突触易感性和记忆下降。因此,在衰老和AD发病过程中,骨细胞来源的硬化蛋白异常升高可能通过抑制神经元中Wnt -β-catenin信号传导而导致认知障碍。
该研究发现骨细胞来源的硬化蛋白可以在衰老和AD进展过程中通过与LRP6受体结合介导脑内Wnt -β-catenin通路的功能障碍。临床和动物研究结果表明,在AD进展过程中,异常升高的硬化蛋白水平通过β-连环蛋白- β分泌酶1 (BACE1)信号传导增加Aβ的产生,从而加速认知功能障碍。该研究揭示了骨因子硬化素在病理条件下介导骨脑串扰,为老年个体和AD患者认知障碍的治疗策略的发展提供了证据。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


