CRM:乳酸终于出卖了肿瘤!科学家发明新型给药系统,专打产生乳酸的肿瘤
来源:奇点糕 2025-01-30 15:02
该乳酸响应给药系统,利用肿瘤产生乳酸这一特征,大幅提升了药物对肿瘤的靶向性和治疗效果。
肿瘤通过有氧糖酵解(瓦博格效应)产生的乳酸,简直是恶贯满盈。
我们曾经介绍过,乳酸可以将瘤内的巨噬细胞从抗癌型变成促癌型[1-3],可以增强调节性T细胞的免疫抑制功能[4],还能把PD-1抑制剂变成促进免疫抑制的“毒药”[5]。
去年4月份,苏州大学团队还发现乳酸会导致抑癌蛋白p53乳酸化,失去抗癌功能[6];同年7月,中山大学团队又发现,乳酸会促进癌细胞修复DNA损伤,帮助癌细胞抵抗放化疗[7]。
乳酸给肿瘤带去那么多好处,难道我们就没有办法治它了么?
近日,由芝加哥大学吴小阳/Huang Jun领衔的研究团队,在著名期刊Cell Reports Medicine上发表一篇重要研究论文[8],创新性发明了一种乳酸特异性给药系统,专门针对爱产乳酸的肿瘤。采用这个给药系统之后,可以大幅提高抗癌药的肿瘤组织特异性和疗效。

▲ 论文首页截图
与健康组织相比,肿瘤组织的代谢发生了重编程。有氧糖酵解或瓦博格效应,是癌细胞的共同特征。
这种代谢的变化会促使肿瘤产生大量的乳酸,导致肿瘤微环境乳酸浓度(10-40mM)升高到健康组织(1mM)的十到数十倍。
大量的乳酸聚集会导致肿瘤组织的pH值降低,虽然当前已经存在pH值响应型给药系统,但是这些系统往往需要强酸环境,而肿瘤微环境还达不到;另外,pH也不具有肿瘤特异性。
为了解决上述难题,吴小阳团队开发了一款乳酸响应给药系统——酶辅助Janus介孔二氧化硅纳米颗粒。这个给药系统中包含了特异性识别乳酸的乳酸氧化酶,乳酸氧化酶会把乳酸分解成丙酮酸和过氧化氢,过氧化氢可以作用于给药系统,导致药物的释放。
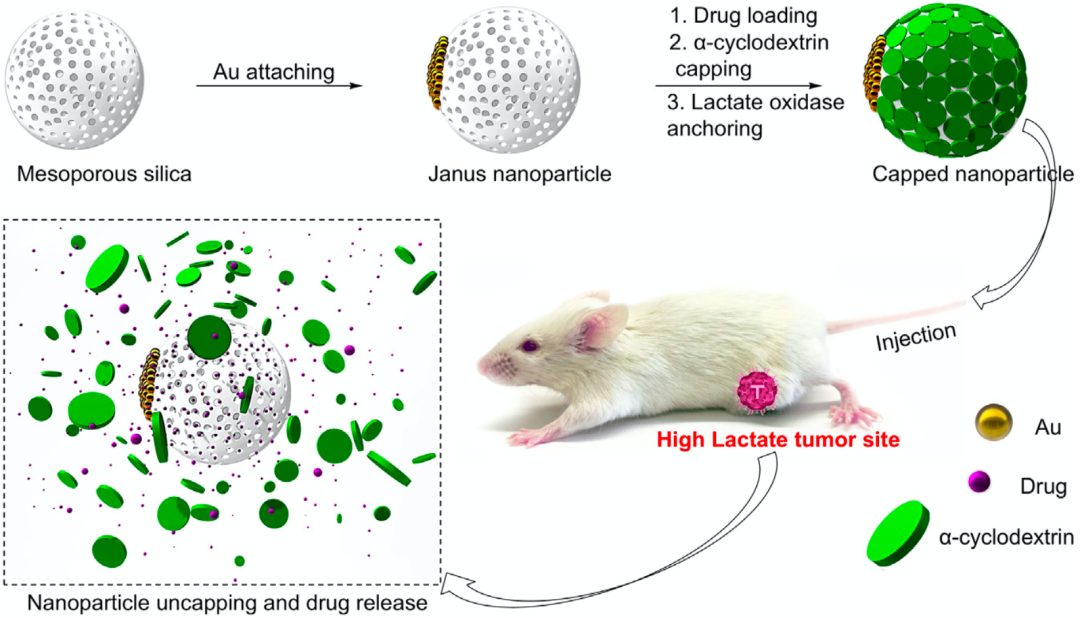
▲ 乳酸响应给药系统示意图
有了上面的给药系统之后,就要测试它的载药和给药能力了。吴小阳团队选择的抗癌药物,是自带荧光的常用化疗药多柔比星。
通过静脉注射给药小鼠一个小时之后,就可在肿瘤和一些器官中检测到荧光信号。吴小阳团队还注意到,与直接注射多柔比星或pH响应系统相比,注射乳酸响应系统的小鼠,多柔比星在肿瘤中的分布有特异性增加,而在其他健康器官(包括心脏、肝脏、肌肉和肾脏)中的分布则没有增加。
从下图可以直观地看出,乳酸响应系统具有肿瘤特异性,而且往肿瘤内给药的效率非常高,瘤内抗癌药峰值浓度可增加10倍左右。
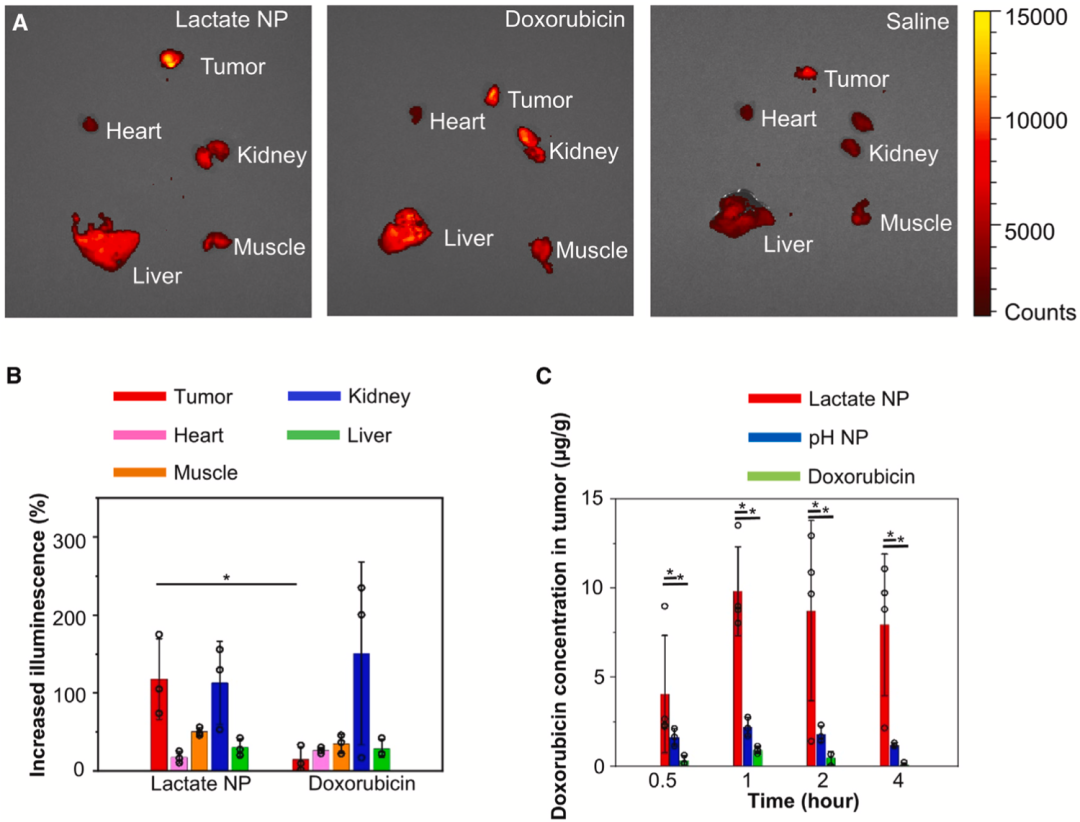
▲ 不同给药方式的比较
基于4T1乳腺癌细胞系的荷瘤小鼠研究显示,乳酸响应给药系统治疗的小鼠肿瘤体积显著缩小,生存时间显著延长。
值得一提的是,即使是对于已经发生肺转移的乳腺癌小鼠模型,乳酸响应给药系统也能抑制转移灶的生长,并延长小鼠存活时间。
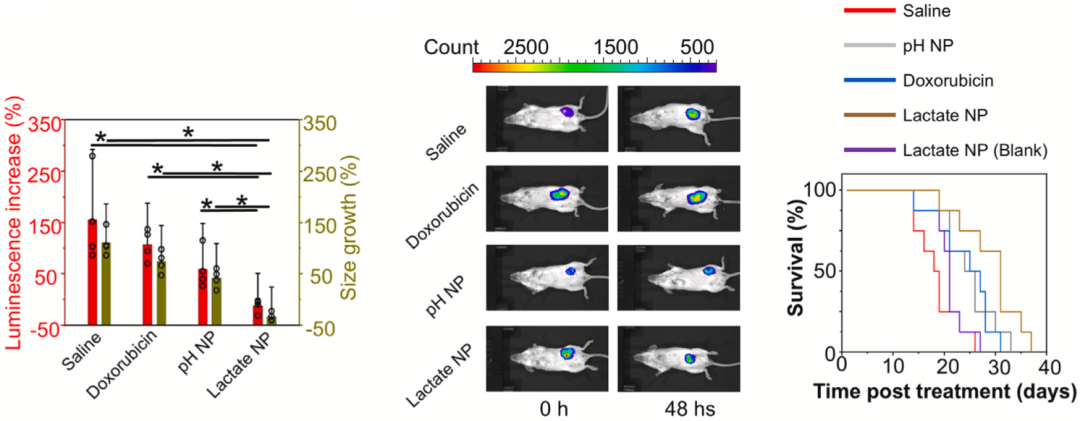
▲ 乳酸响应给药系统的抗肿瘤效果
除了化疗药物多柔比星之外,吴小阳团队还测试了用乳酸响应给药系统搭载小分子STING激动剂SR-717的抗癌效果。
从研究结果来看,这种给药方式也能提升免疫治疗药物SR-717的抗癌效果。此外,他们还测试了搭载SR-717的乳酸响应给药系统联合PD-1抑制剂的治疗效果。从下图曲线可以看出,与其他疗法相比,联合治疗的疗效非常突出。
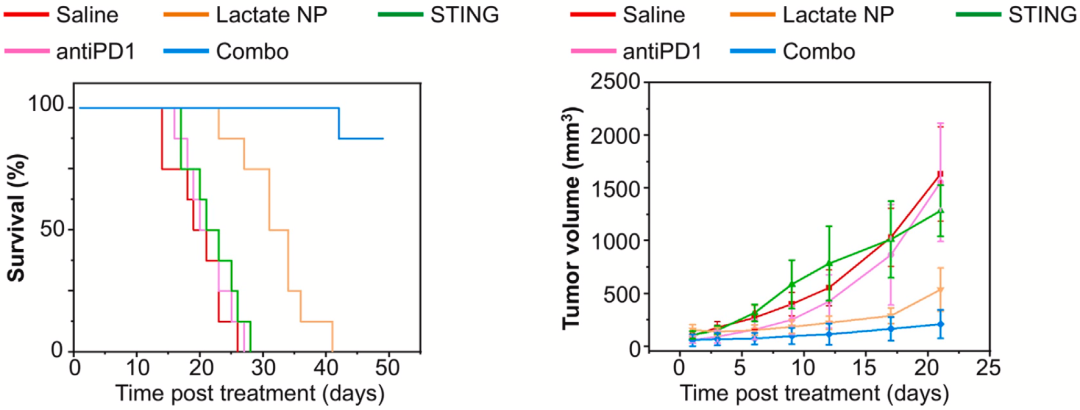
▲ 不同给药方式的SR-717治疗效果
从上述研究结果不难看出,吴小阳/Huang Jun团队开发的这个乳酸响应给药系统,利用肿瘤产生乳酸这一特征,大幅提升了药物对肿瘤的靶向性和治疗效果。
未来有必要基于这个给药系统开展更多的研究,让当下的抗癌药物能更好地作用于肿瘤。
参考文献:
[1].Bohn T, Rapp S, Luther N, et al. Tumor immunoevasion via acidosis-dependent induction of regulatory tumor-associated macrophages. Nat Immunol. 2018;19(12):1319-1329. doi:10.1038/s41590-018-0226-8
[2].Zhang D, Tang Z, Huang H, et al. Metabolic regulation of gene expression by histone lactylation. Nature. 2019;574(7779):575-580. doi:10.1038/s41586-019-1678-1
[3].Qian Y, Galan-Cobo A, Guijarro I, et al. MCT4-dependent lactate secretion suppresses antitumor immunity in LKB1-deficient lung adenocarcinoma. Cancer Cell. 2023;41(7):1363-1380.e7. doi:10.1016/j.ccell.2023.05.015
[4].Watson MJ, Vignali PDA, Mullett SJ, et al. Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature. 2021;591(7851):645-651. doi:10.1038/s41586-020-03045-2
[5].Kumagai S, Koyama S, Itahashi K, et al. Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell. 2022;40(2):201-218.e9. doi:10.1016/j.ccell.2022.01.001
[6].Zong Z, Xie F, Wang S, et al. Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell. 2024;187(10):2375-2392.e33. doi:10.1016/j.cell.2024.04.002
[7].Chen H, Li Y, Li H, et al. NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance. Nature. 2024;631(8021):663-669. doi:10.1038/s41586-024-07620-9
[8].Zhang J, Pan T, Lee J, et al. Enabling tumor-specific drug delivery by targeting the Warburg effect of cancer. Cell Rep Med. Published online January 7, 2025. doi:10.1016/j.xcrm.2024.101920
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


