Circulation | 空军军医大学吴元明/刘丽文等合作发现心肌病的致病新机制
来源:生物探索 2024-03-08 11:33
该研究发现FARS2是遗传性心肌病的潜在致病基因,FARS2缺乏通过损害线粒体稳态和破坏MQC系统导致心脏肥厚。
空军军医大学吴元明、刘丽文、Chen Kun共同通讯在Circulation(IF 38)在线发表题为“FARS2 Deficiency Causes Cardiomyopathy by Disrupting Mitochondrial Homeostasis and the Mitochondrial Quality Control System”的研究论文,该研究表明FARS2缺乏通过破坏线粒体稳态和线粒体质量控制系统引起心肌病。该研究在HCM患者中发现了7个未报道的FARS2变异。心脏特异性Fars2缺陷小鼠表现为心脏肥厚、左心室扩张、进行性心力衰竭伴心肌和线粒体功能障碍、寿命短。杂合子心脏特异性Fars2R415L小鼠在4周龄时表现出心肌肥厚的倾向,并伴有心肌功能障碍。此外,Fars2敲低的斑马鱼出现心包水肿和心力衰竭。
FARS2缺陷通过直接阻断mt-tRNAPhe的氨基酰化和抑制线粒体蛋白的合成来破坏线粒体稳态,最终通过加速线粒体超片段化和破坏线粒体相关的自噬,导致线粒体质量控制系统失衡。使用腺相关病毒9或特异性抑制剂干扰线粒体质量控制系统,通过恢复线粒体稳态,减轻由FARS2缺陷引发的心脏和线粒体功能障碍。该研究揭示了先前未被认识到的FARS2在心脏和线粒体稳态中的作用,为遗传性心肌病的分子诊断和预防以及FARS2相关心肌病的治疗选择提供新的见解。

肥厚性心肌病(HCM)是最常见的遗传性心肌病,发病率约为1/500。HCM以左心室不对称增厚和舒张功能受损为特征,是心力衰竭(HF)和心源性猝死的主要原因在过去的20年里,分子遗传学的进展已经揭示了超过1000个与HCM相关的遗传变异,其中大多数与肌体基因有关,如MYH7和MYBPC3。然而,相当比例的HCM患者没有表现出任何已知遗传变异的证据。因此,其他新的致病变异可能负责或促成这些患者的HCM表型。
线粒体独立于细胞质,具有由线粒体DNA (mtDNA)编码的tRNA、核糖体RNA和核DNA编码的线粒体氨基酰基tRNA合成酶(mtARS)调节的翻译机制。超过1500个线粒体蛋白中只有13个是在线粒体中合成的。这13种蛋白构成了OXPHOS复合物的关键亚基,mtARS负责线粒体蛋白的合成,其中涉及到tRNA与其同源氨基酸的共价配对。全基因组测序的广泛应用揭示了与疾病相关的mtARS编码基因的多种变异,这些变异主要在需要高能量的器官中观察到。尽管酶具有共同的生化作用,但mtARS变异患者的广泛临床表现涉及不同的生理系统然而,mtARS编码基因的变异在很大程度上与中枢神经系统有关。只有一些变异,包括AARS2、VARS2、PARS2和YARS2,被确定为人类心肌病的病因,但病理机制尚不清楚。所有已知的FARS2变异仅与中枢神经系统相关疾病有关,如遗传性痉挛性截瘫FARS2变异与其他全身性疾病的相关性尚未报道。
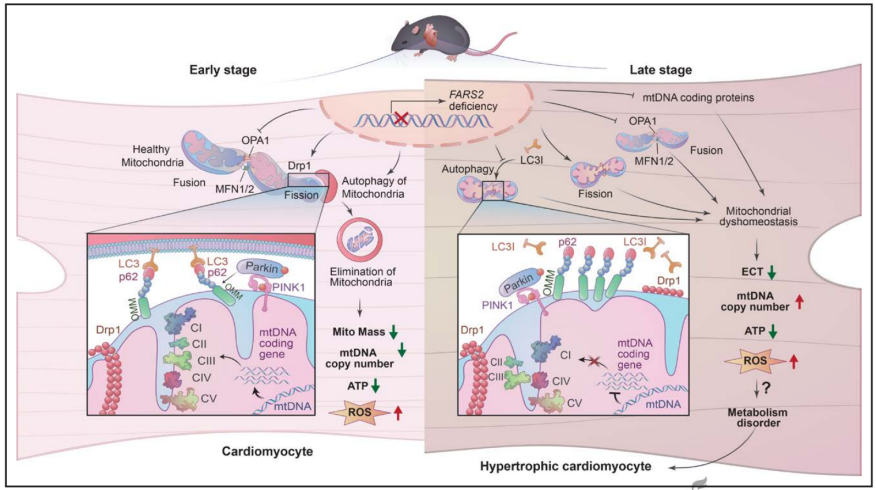
FARS2缺乏通过破坏线粒体稳态和线粒体质量控制系统引起心肌病(Credit: Circulation)
线粒体功能、形态和质量的维持,也称为线粒体稳态,对心脏功能和衰老至关重要线粒体质量控制(MQC)系统是一个强大的协调器,在基础条件和各种应激条件下(如心脏重构)维持线粒体稳态。复杂的信号通路构成了MQC系统,包括线粒体裂变、融合和线粒体相关的自噬。已有研究揭示了MQC系统的关键功能分子在心脏功能和应激诱导重构中的作用。然而,mtARS相关HCM的分子机制尚不清楚,线粒体稳态变化和MQC系统的作用也不清楚。
该研究发现FARS2是遗传性心肌病的潜在致病基因。FARS2缺乏通过损害线粒体稳态和破坏MQC系统导致心脏肥厚。该研究不仅强化了FARS2在心脏病中的生物学功能,而且为线粒体翻译缺陷相关HCM的潜在预防和FARS2相关心肌病的治疗靶点提供了新的见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


