ACS AMI:聚多酚衍生的纳米颗粒用于炎症性肠病治疗
来源:ACS材料X 2022-06-02 15:47
本工作构建了一种基于儿茶酚的核壳结构(MPDA-siRNA@CaP)纳米医药系统
英文原题:Polycatechol-Derived Mesoporous Polydopamine Nanoparticles for Combined ROS Scavenging and Gene Interference Therapy in Inflammatory Bowel Disease
作者:Liucan Wang (王刘灿), Zhenqiang Wang (王振强), Yiyang Pan (潘逸扬), Shuaishuai Chen (陈帅帅), Xin Fan (樊欣), Xiaolong Li (李小龙), Guoqing Chen (陈国庆), Yuanhang Ma (马远航), Yujiao Cai (蔡瑜娇), Jixi Zhang (张吉喜)
炎症性肠病(IBD)是一种慢性特发性胃肠道炎症疾病,具炎症活性氧(ROS)清除和基因干扰协同的纳米医药系统在IBD的治疗中颇具潜力,但siRNA的保护和ROS清除材料的有机复合是亟需解决的关键科学问题。赋予基因载体以抗氧化能力,有望解决基因治疗和抗氧化剂损伤治疗的功能整合,简化合成过程。
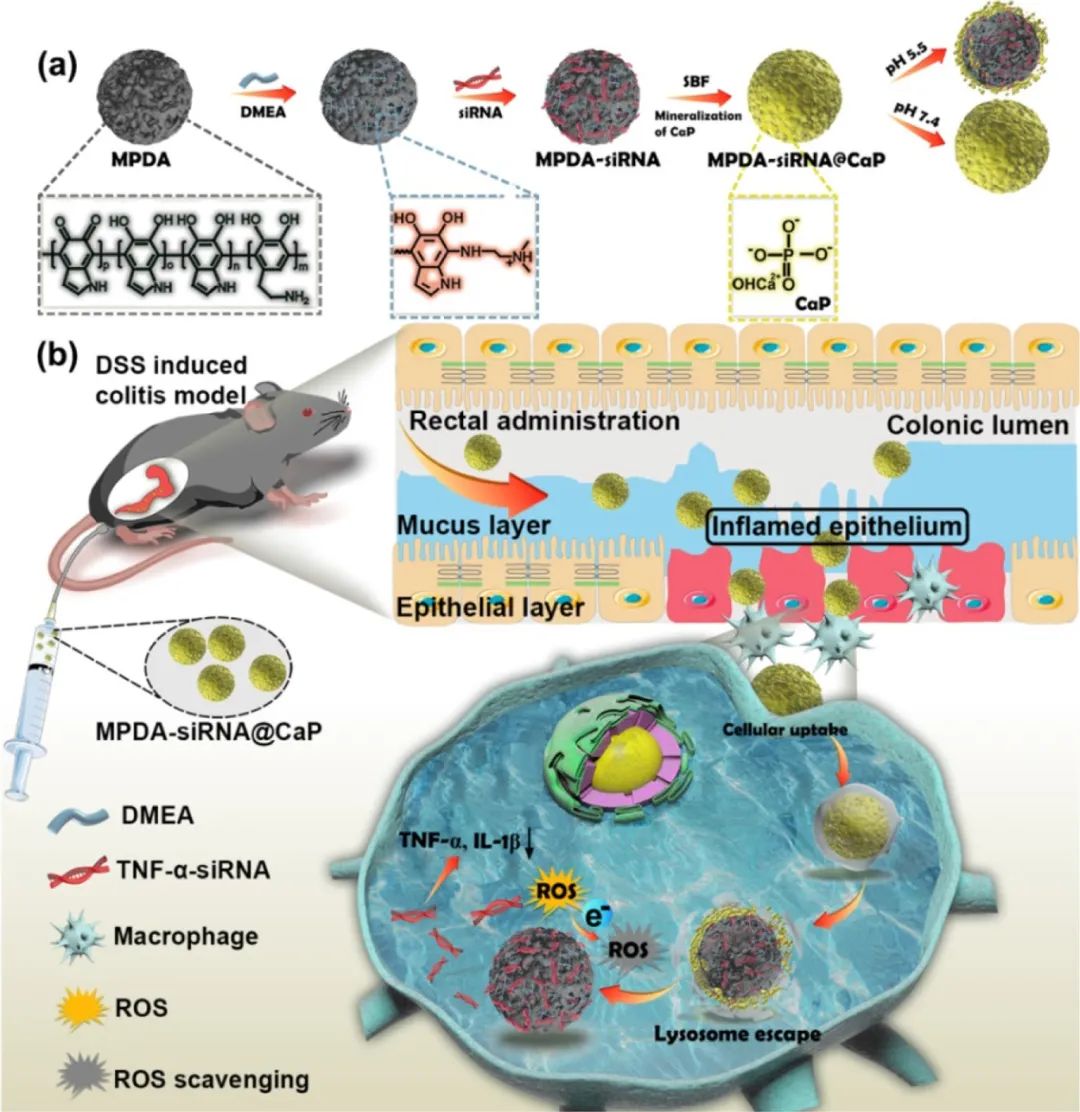
图1. 核壳结构纳米医药系统的合成过程及体内组合治疗示意图。
文章亮
近日,陆军军医大学新桥医院普通外科肖卫东教授、于敏研究员以及中国科学院大学重庆市人民医院普通外科杨桦教授在ACS Applied Materials & Interfaces上发表了聚多酚衍生的介孔聚多巴胺(MDPA)纳米颗粒用于炎症性肠病的ROS清除和基因干扰联合治疗的研究工作。本工作构建了一种基于儿茶酚的核壳结构(MPDA-siRNA@CaP)纳米医药系统,该系统以二甲基乙醇胺(DMEA)修饰的具抗氧化能力的MPDA作为介孔载药核心,以聚多酚诱导的生物矿化壳层磷酸钙(CaP)作为保护性外壳,用于直肠给药条件下IBD的治疗探索。
研究表明,DMEA修饰的MPDA纳米颗粒可有效装载TNF-α-siRNA(31%),且具有丰富儿茶基团的PDA在缓解氧化应激方面表现出特有的氧化还原能力,可以清除多种活性氧自由基。体外研究表明,该核壳结构纳米系统能够减少胞内活性氧的产生,抑制促炎症细胞因子(TNF-α和IL-1β)的表达。
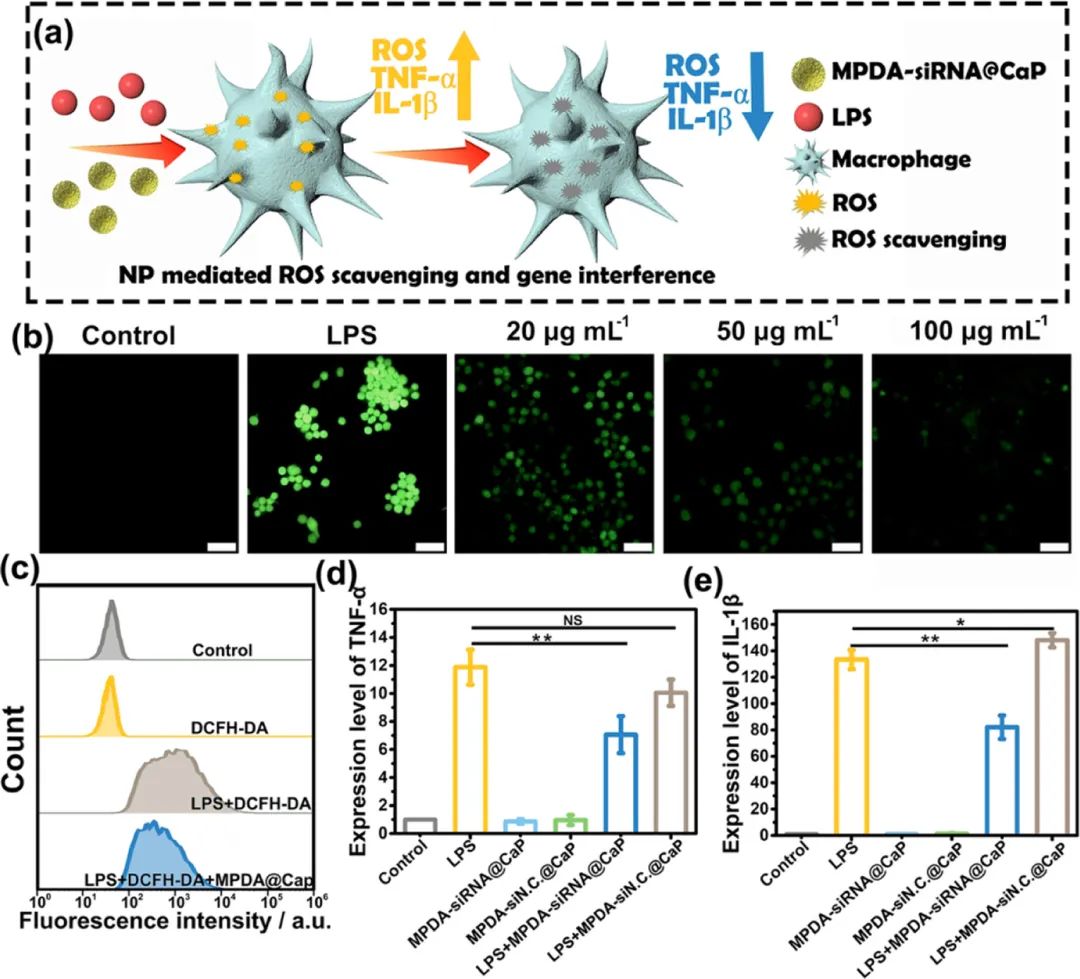
图2. 胞内ROS清除及炎症抑制效果评估。
体内相关研究表明,通过直肠给药,纳米系统特有的抗氧化特性可有效抑制由于肠道炎症导致的出血、体重减轻和对结肠粘膜的破坏,促进肠道紧密连接蛋白的表达,恢复被破坏的结肠屏障。此外,该核壳纳米平台对TNF-α-siRNA的保护性运输实现了体内的基因干扰治疗和TNF-α的表达抑制,这种组合治疗的协同作用模式实现了肠道炎症的有效抑制。
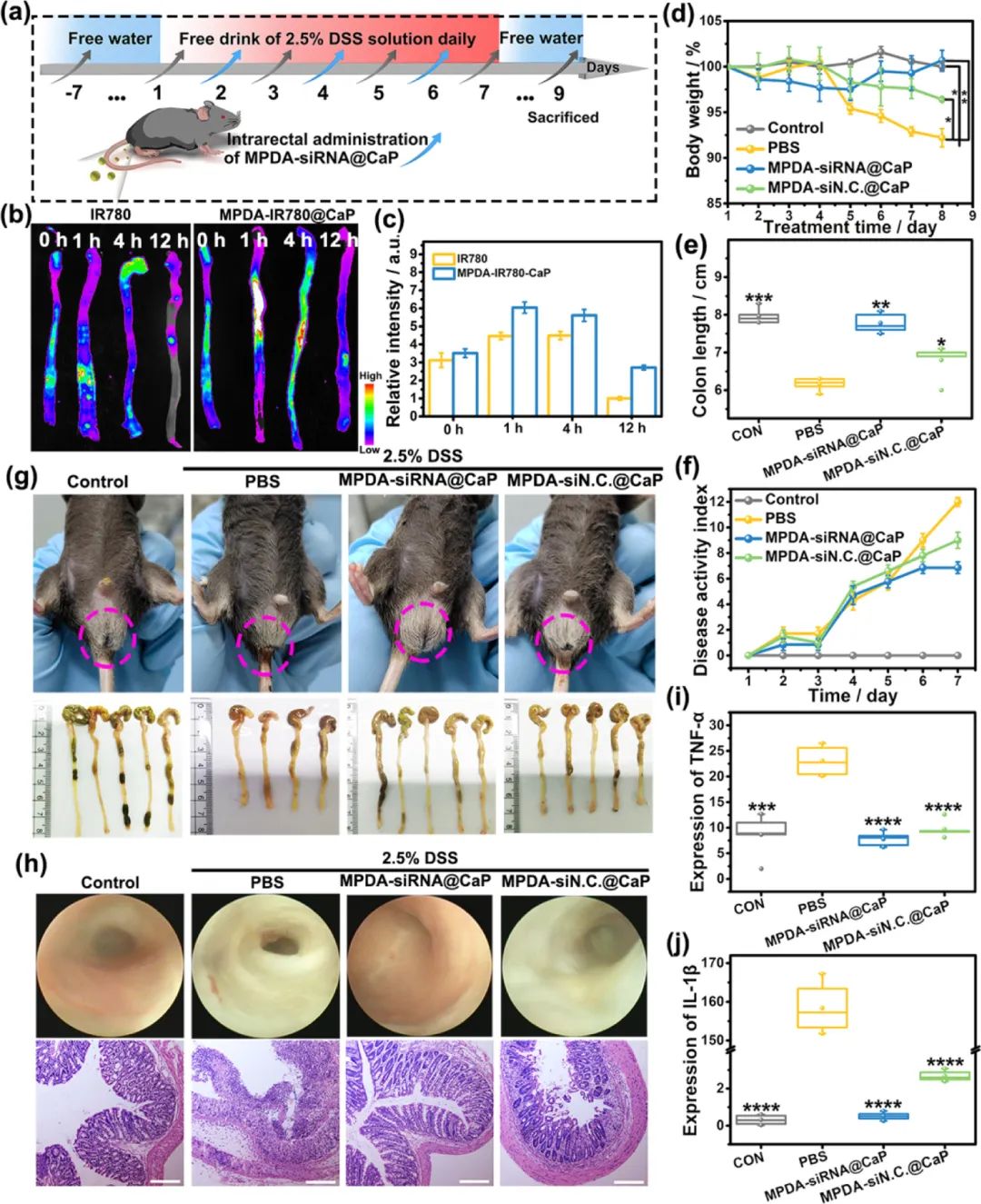
图3. 纳米系统的体内肠道炎症抑制
总结/展
研究团队通过邻苯二酚基团和叔胺在MPDA表面的协同作用,以及PDA诱导的生物矿化CaP涂层,设计合成了具广谱ROS清除及基因干扰协同作用的纳米系统。该研究不仅为实现抗氧化剂和基因药物的协同整合及新型纳米系统开发奠定基础,还将为IBD的抗氧化和基因干扰组合治疗提供思路。
相关论文发表在ACS Applied Materials & Interfaces上,陆军军医大学新桥医院普外科助理实验师王刘灿为文章的第一作者,重庆大学生物工程学院博士生王振强,陆军军医大学博士生潘逸扬为共同第一作者。中国科学院大学重庆市人民医院普通外科杨桦教授、陆军军医大学新桥医院普通外科肖卫东教授和陆军军医大学新桥医院普通外科于敏研究员为通讯作者。(生物谷 BIOON)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


