PNAS: CD4受体多样性展现灵长类物种抵抗免疫缺陷病毒的保护机制
来源:本站原创 2021-04-07 00:29
人和猿猴免疫缺陷病毒(HIV / SIV)对宿主的感染依赖于病毒包膜糖蛋白(Env)与免疫细胞表面的宿主蛋白CD4结合。尽管在人类中该结构域相对稳定,但黑猩猩CD4的Env结合域则存在高度多态性:在野生种群中有9个不同的变体。在最近发表在《PNAS》杂志上的一项研究中,来自宾夕法尼亚大学的Beatrice H. Hahn团队发现: CD4多样性并非黑猩猩独有
2021年4月7日讯/生物谷BIOON/---人和猿猴免疫缺陷病毒(HIV / SIV)对宿主的感染依赖于病毒包膜糖蛋白(Env)与免疫细胞表面的宿主蛋白CD4结合。尽管在人类中该结构域相对稳定,但黑猩猩CD4的Env结合域则存在高度多态性:在野生种群中有9个不同的变体。在最近发表在《PNAS》杂志上的一项研究中,来自宾夕法尼亚大学的Beatrice H. Hahn团队发现: CD4多样性并非黑猩猩独有,许多其它非洲灵长类物种中也存在上述CD4受体多样性。

(图片来源:www.pnas.org)
在这项研究中,作者对超过500只猿类的CD4蛋白最外层(D1)结构域进行了表征。结果显示,29个灵长类物种中有24个存在多态性残基,其中一个物种中鉴定出多达11种不同的变体。感染实验结果显示:D1结构域氨基酸置换会影响SIV膜蛋白 Env介导的侵染过程。此外,作者在不同属的灵长类动物中发现了几种相同的CD4多态性,包括添加了N-连接的糖基化位点,为物种的平行进化提供了新的佐证。这些数据表明,灵长类动物CD4蛋白的HIV / SIV Env结合区在物种内部和物种之间都高度可变,并表明这种多样性通过平衡选择已经维持了几百万年,而且至少部分原因是为了保护宿主免受灵长类慢病毒的侵染。此外,尽管长期感染SIV的物种已发展出避免疾病进展的特定机制,但灵长类慢病毒具有内在致病性,并已在宿主基因组上留下了印记。
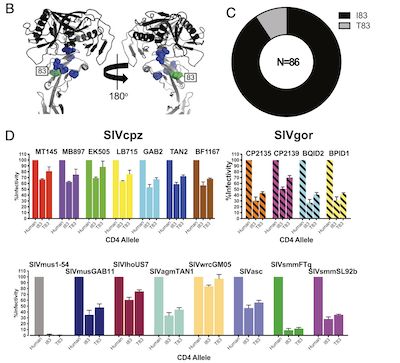
(图1,黑猩猩CD4序列多样性及其感染能力比较分析)
首先,作者比较了野生黑猩猩以及人类的CD4 alpha链序列差异。结果显示,人与黑猩猩的CD4 蛋白2号外显子序列完全一致,部分黑猩猩个体3号外显子83号位点存在一个氨基酸突变(I83T)。感染实验结果表明,相比人类CD4受体,两种不同变体(I83,T83)的黑猩猩CD4蛋白受一系列SIV感染的效率均明显较低。进一步,作者比较了大猩猩与人类CD4蛋白的序列差异,发现其中18,27,31,34号位点的氨基酸存在变异,其受一系列SIV感染的效率均不同程度地低于人源CD4受体。
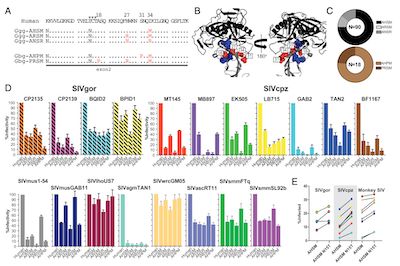
(图2,大猩猩CD4序列多样性及其感染能力比较分析)
除此之外,作者在不同类型的非洲猿类中均发现了CD4 alpha链的物种内与物种间序列多样性。这些数据表明,灵长类CD4受体处于长期平衡选择之下,并且这种多样化是灵长类慢病毒与其宿主之间共同进化“军备竞赛”的结果。(生物谷 Bioon.com)
原始出处:Ronnie M. Russell, Frederic Bibollet-Ruche, Weimin Liu, et al., CD4 receptor diversity represents an ancient protection mechanism against primate lentiviruses. Proceedings of the National Academy of Sciences Mar 2021, 118 (13) e2025914118; DOI: 10.1073/pnas.2025914118
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


