《自然·神经科学》:贝勒医学院团队发现tau蛋白磷酸化和聚集的新机制!
来源:奇点糕 2024-11-23 11:03
2023年,美国贝勒医学院Huda Yahya Zoghbi 团队就在《神经元》上发文,他们通过跨物种遗传筛选,发现酪氨酸激酶2(TYK2)可能是一个调节tau蛋白水平的重要因子,但至于
2023年,美国贝勒医学院Huda Yahya Zoghbi 团队就在《神经元》上发文,他们通过跨物种遗传筛选,发现酪氨酸激酶2(TYK2)可能是一个调节tau蛋白水平的重要因子,但至于TYK2是如何调节tau蛋白水平的,还不清楚。
近期,Huda Yahya Zoghbi 团队再次发文,进一步验证了,TYK2之所以是一个调节tau蛋白水平的重要因子,是因为TYK2可通过磷酸化tau蛋白的酪氨酸残基(Tyr29),来影响tau蛋白的稳定和聚集。
具体来说,这种磷酸化增加了tau蛋白的稳定性,使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集。而在tau病理小鼠模型中,研究人员发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症。
研究发表在《自然·神经科学》上[1]。

论文首页截图
通过在人类神经母细胞瘤细胞系和小鼠大脑中减少Tyk2的表达,研究人员观察到,随着Tyk2表达的减少,tau蛋白的浓度也随之降低。这也意味着,TYK2确实能够调节tau蛋白水平。
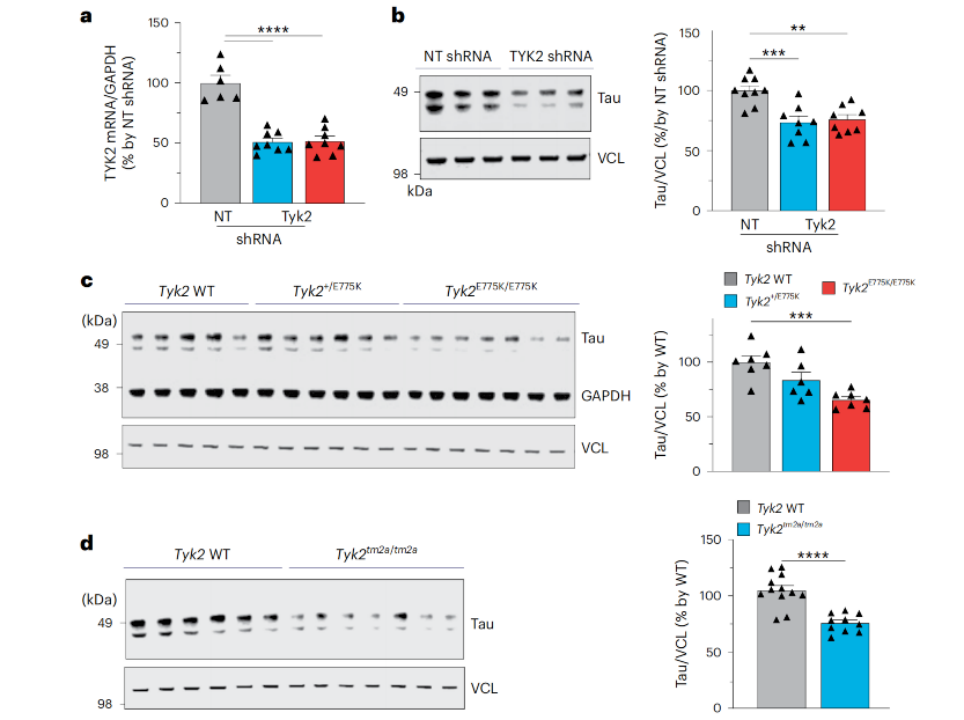
TYK2调节tau蛋白水平
进一步的免疫共沉实验结果显示,TYK2与tau蛋白存在相互作用。鉴于TYK2是一种酪氨酸激酶,可以在底物蛋白上磷酸化酪氨酸残基,因此,研究人员猜想,TYK2与tau蛋白结合位点可能在酪氨酸残基上,并以此来实现对tau蛋白的磷酸化。
为了验证这一猜想,研究人员进行了体外细胞激酶实验和免疫印迹分析。结果也证实,在TYK2存在的情况下,tau蛋白的酪氨酸残基确实被磷酸化了。
根据既往研究,tau蛋白共有5个可以被磷酸化的酪氨酸残基,分别是Tyr18、Tyr29、Tyr197、Tyr310和Tyr394。为了找到究竟哪个残基被TYK2特异性磷酸化了,研究人员分别用苯丙氨酸取代了tau蛋白的每个酪氨酸残基,然后再进行体外激酶实验,检测TYK2的磷酸化作用。
结果发现,只有Tyr29残基被苯丙氨酸取代的时候,TYK2介导的磷酸化才会消失。这也意味着Tyr29是TYK2磷酸化tau蛋白的关键位点。
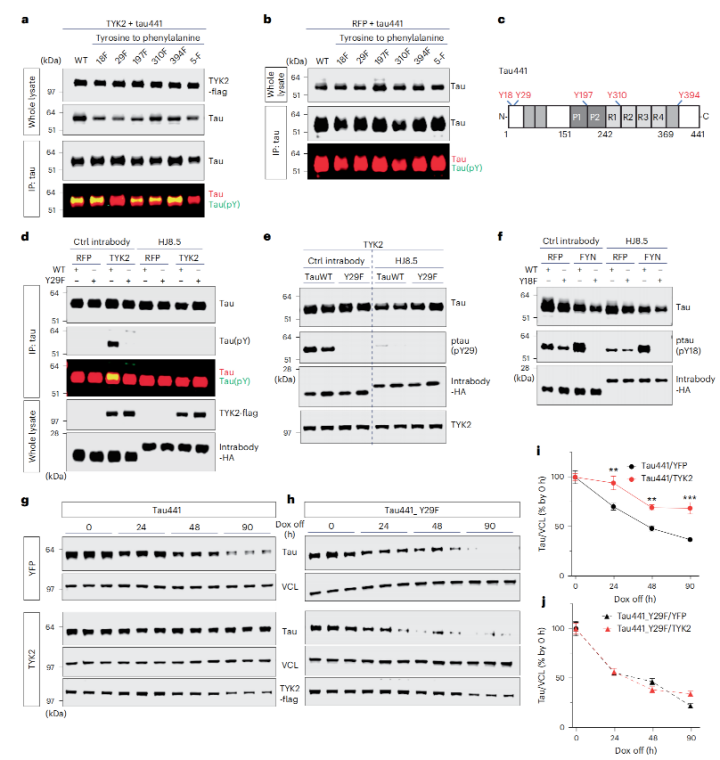
TYK2与tau蛋白结合,并特异性磷酸化了tau蛋白的Tyr29
接下来,研究人员探讨了TYK2介导的tau磷酸化在tau病理中的作用。结果发现,TYK2介导的磷酸化增加了tau蛋白的稳定性,并使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集(具体表现为在TYK2存在的情况下,tau蛋白的周转率,也就是tau蛋白在细胞内被降解的速度变慢了,而敲低Tyk2能够改善这一现象,尤其是在Tyr29被苯丙氨酸取代后,TYK2介导的磷酸化完全消失)。
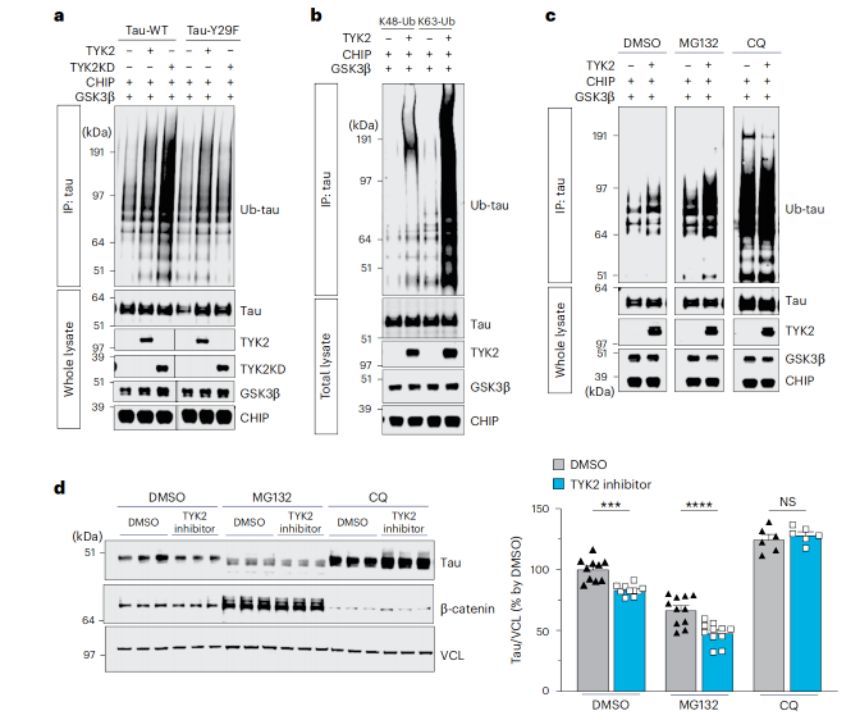
TYK2介导的磷酸化阻碍了tau蛋白通过自噬途径降解
进一步,研究人员还在tau病理小鼠模型中探讨了TYK2的作用。通过构建含有TYK2激酶域(TYK2KD)的P301S tau小鼠,研究人员再次证实,这种激酶可以通过磷酸化tau蛋白的Tyr29,引发小鼠脑内病理性tau蛋白的大量积累(而当Tyr29被苯丙氨酸取代后,这一现象就会消失)。
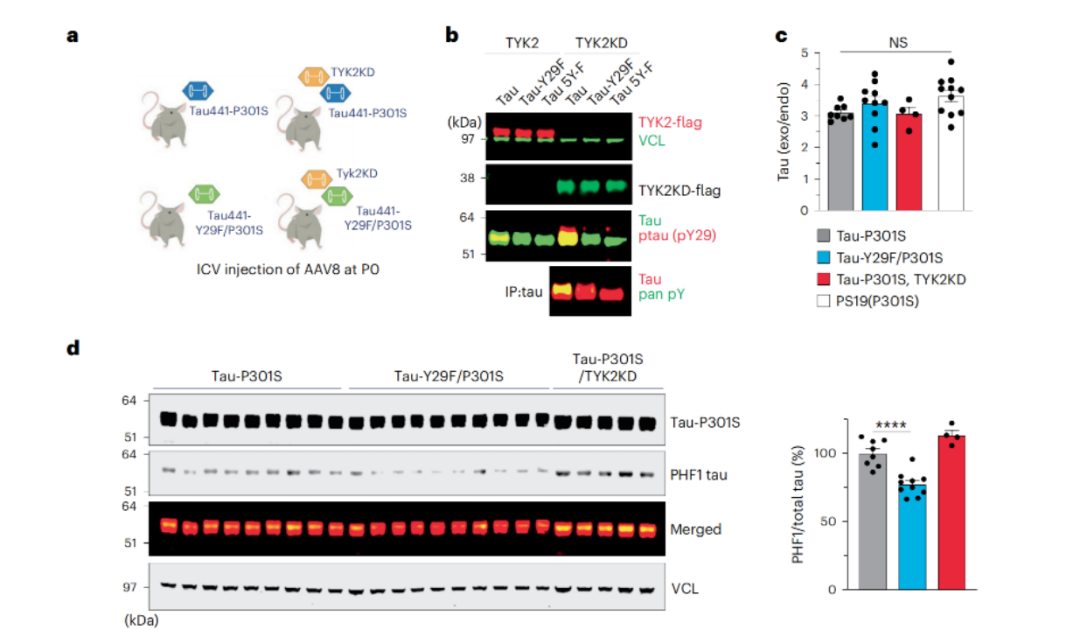
TYK2介导的磷酸化引发小鼠脑内病理性tau蛋白的大量积累
相反,当研究人员构建Tyk2敲低的PS19 tau小鼠模型后发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症(如小胶质细胞增生减少)。
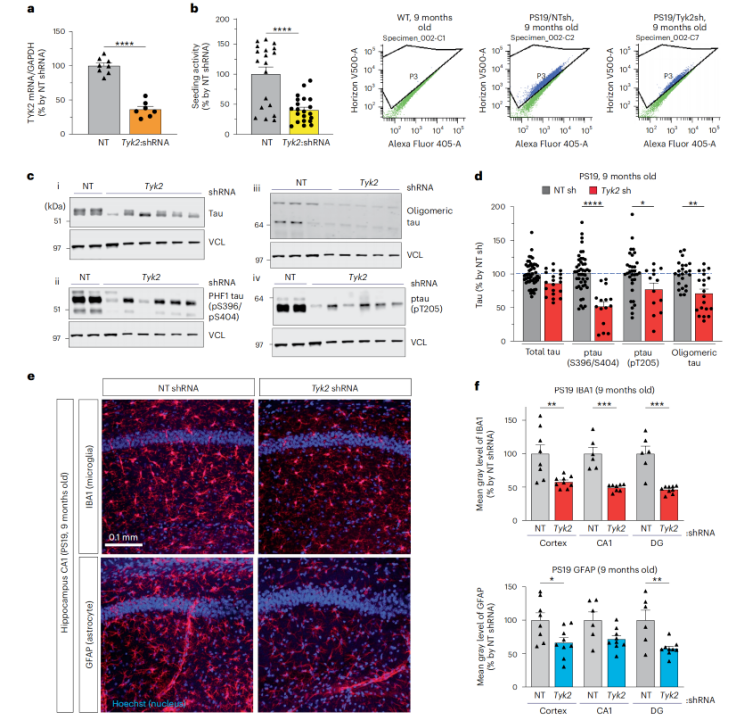
敲低Tyk2后,总tau和致病性tau蛋白的水平下降
综上,该研究首次证实,TYK2可通过磷酸化tau蛋白的Tyr29残基,来影响tau蛋白的稳定和聚集。这一发现不仅揭示了tau蛋白异常聚集的新机制,也为tau蛋白病的治疗提供了新的靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


