2024年5月Science期刊精华
来源:生物谷原创 2024-05-30 10:52
2篇Science+2篇Science子刊表明HIV疫苗开发迈出重要一步、开发男性避孕药有戏!新研究发现靶向抑制STK33可使雄性小鼠不育,而且这种抑制是可逆的
2024年5月份即将结束,5月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1. 2篇Science+2篇Science子刊表明HIV疫苗开发迈出重要一步
doi:10.1126/science.adk0582; doi:10.1126/sciimmunol.adn0622; doi:10.1126/science.adj8321; doi:10.1126/scitranslmed.adn0223
在全球抗击艾滋病的征途上,疫苗研发的突破性进展犹如夜空中明灯。科学家们聚焦于生殖系靶向(germline-targeting)这一前沿方法,旨在激活初始B细胞,逐步引导其产生能广泛中和HIV的抗体,即bnAbs,这些抗体能靶向HIV极少变异的保守位点。
大量研究已证实了这种初始激活步骤的可行性;如今,在两项新的研究中,来自拉根研究所的研究人员开发出一个用于HIV疫苗研究的综合平台,其既能对下一步的加强免疫原(boost immunogen)进行临床前验证,又能对所产生抗体反应的基础生物学提供新的见解。
相关研究结果发表在Science期刊和Science Immunology期刊上,其标题分别为“mRNA-LNP HIV-1 trimer boosters elicit precursors to broad neutralizing antibodies”和“mRNA-LNP prime boost evolves precursors toward VRC01-like broadly neutralizing antibodies in preclinical humanized mouse models”。
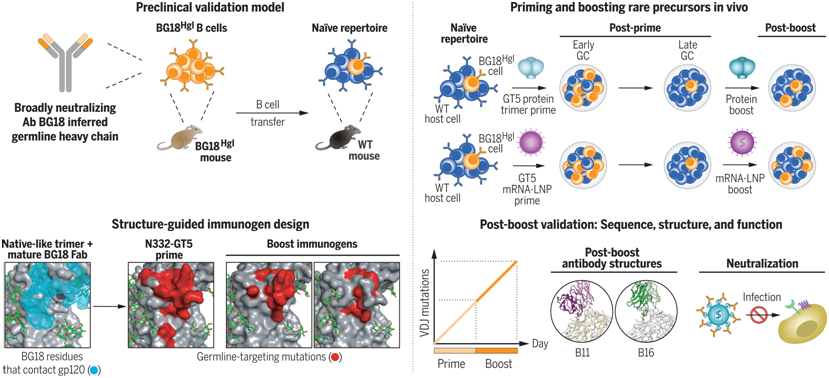
图片来自Science, 2024, doi:10.1126/science.adk0582
与此同时,来自斯克里普斯研究所的研究人员在Science期刊和Science Translational Medicine期刊上发表了另外两项新的研究,其标题分别为“Vaccine priming of rare HIV broadly neutralizing antibody precursors in nonhuman primates”和“Heterologous prime-boost vaccination drives early maturation of HIV broadly neutralizing antibody precursors in humanized mice”。这四篇论文是这两家研究机构多年密切合作的成果,也是向HIV疫苗迈出的重要一步。
拉根研究所副所长兼科学主任Facundo D. Batista 博士解释说,“人源化小鼠模型是我们进行HIV项目的关键工具。敲入的人类 B 细胞受体被鉴定为潜在的 bnAb 前体,我们可以观察它们作为完整哺乳动物免疫系统的一部分如何对免疫原做出反应。我们利用了一种基于CRISPR的方法培育出了小鼠品系,以研究HIV包膜上的几个已知保守位点,而且我们在斯克里普斯研究所的合作者已针对这些位点开发出了免疫原。”
虽然论文第一作者Zhenfei Xie博士和Xuesong Wang博士都在拉贡研究所的Batista实验室完成了各自的基础研究工作,但他们各自关注的是HIV Env上的不同保守位点和免疫接种基础生物学的不同方面。不过,这两位科学家对递送形式都得出了相似的结论:辉瑞公司和莫德纳公司COVID-19疫苗所采用的mRNA-LNP系统对HIV加强免疫原非常有效。
Xie博士认为,William Schief教授领导的斯克里普斯研究所免疫原设计团队的研究结果与Batista实验室的免疫生物学研究结果之间的一致性是关键因素。“针对HIV-1的bnAb是HIV感染者漫长历程中不常见的成果。Jon Steichen 从 bnAb 和HIV的共同进化轨迹出发,了解它们的结构是如何相互作用的,然后我们把一切都搬回了体内模型,在那里我们可以开始观察更复杂的现象,比如抗体竞争。这种合作对于证明这些类型的特异性位点增强能够起作用至关重要。”
2.Science:开发男性避孕药有戏!新研究发现靶向抑制STK33可使雄性小鼠不育,而且这种抑制是可逆的
doi:10.1126/science.adl2688
在一项新的研究中,来自贝勒医学院等研究机构的研究人员通过动物模型表明,一种新型的非激素精子特异性方法为可逆的人类男性避孕提供了一种很有前景的选择。相关研究结果发表在2024年5月24日的Science期刊上,论文标题为“Reversible male contraception by targeted inhibition of serine/threonine kinase 33”。
图片来自Science, 2024, doi:10.1126/science.adl2688
论文通讯作者、贝勒医学院药物发现中心主任兼病理学与免疫学系主任Martin Matzuk博士说,“尽管科学家们一直在研究开发男性避孕药的几种策略,但我们仍然没有男性避孕药。在这项研究中,我们专注于一种新方法——确定一种能抑制丝氨酸/苏氨酸激酶33(serine/threonine kinase 33, STK33)的小分子,其中这种蛋白是男性和小鼠生育所必需的。”
先前的研究已表明,STK33富集在睾丸中,是形成功能性精子所特别需要的。在小鼠体内,敲除 Stk33 基因会使小鼠因精子异常和精子活力低下而不育。在男性中,STK33 基因突变也会导致不育,其原因与 Stk33 基因敲除小鼠的精子缺陷相同。最重要的是,具有这些突变的小鼠和男性没有其他缺陷,甚至睾丸大小正常。
Matzuk说,“因此,STK33 被认为是一个可行的靶点,对男性避孕的安全性影响很小。STK33抑制剂已经被描述过,但没有一种抑制剂是STK33特异性的,也没有一种抑制剂能有效地破坏STK33在有机体内的功能。”
doi:10.1126/science.adl1624
脊柱裂(spina bifida)是人类神经系统中的一种最常见的结构性疾病。在一项新的研究中,来自加州大学圣地亚哥分校医学院等研究机构的研究人员为脊柱裂的病因提供了新的见解。他们首次揭示了脊柱裂与人类常见染色体微缺失(microdeletion)之间的联系。他们指出每 2500 名活产婴儿中就有一人携带这种染色体微缺失,其患脊柱裂的风险是普通人的 10 倍多。这项研究还强调了一种常见食物补充剂在降低脊柱裂风险方面的潜在作用。相关研究结果发表在2024年5月3日的Science期刊上,论文标题为“Risk of meningomyelocele mediated by the common 22q11.2 deletion”。
图片来自Science, 2024, doi:10.1126/science.adl1624
加州大学圣地亚哥分校医学院神经科学系的Joseph G. Gleeson博士解释说,脊柱裂又称脊髓脊膜突出(meningomyelocele),每3000名新生儿中就有一人受其影响。不幸的是,其病因大多不明。Gleeson补充说,虽然有一些基因突变的报道,但只能解释很小一部分风险。
为了揭示这种疾病的遗传原因,Gleeson团队与来自全球各地的同事们一起,于2015年成立了脊柱裂测序联盟(Spina Bifida Sequencing Consortium)。该联盟开始关注 22 号染色体上的一种微缺失。染色体微缺失是指一条染色体上的几个基因缺失。这种称为 22q11.2del的22 号染色体微缺失与许多其他疾病有关。他们开始在脊柱裂患者中寻找 22q11.2del。
4.AI赋能降低MRI成本!Science:我国科学家开发出低成本的超低场核磁共振成像技术,让高端影像普及不再是梦
doi:10.1126/science.adm7168
在一项新的研究中,来自中国香港大学的研究人员巧妙融合现成套件与先进人工智能,打造出一款低磁场全身核磁共振成像(MRI)设备,其性能堪比肩高端仪器,有望开启高质量医疗诊断的全民可及时代。相关研究结果发表在2024年5月10日的Science期刊上,论文标题为“Whole-body magnetic resonance imaging at 0.05 Tesla”。
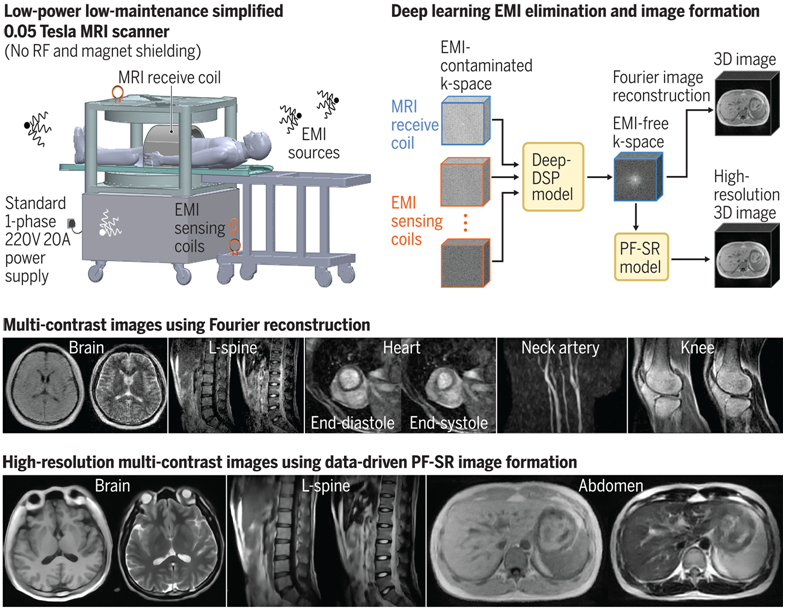
图片来自Science, 2024, doi:10.1126/science.adm7168
核磁共振成像扫描仪于五十年前首次问世,如今已成为现代医学的基石,对于诊断包括中风、肿瘤和脊柱疾病在内的多种疾病至关重要,同时还能避免患者受到辐射。但在发展中国家,这些设备仍然难以获得: 非洲每百万人中只有不到一台核磁共振成像仪,而美国和日本的这一数字分别为每百万人40台和55台。
为了解决这个问题,香港大学的Yujiao Zhao及其同事们利用商店购买的硬件制造了一台简化的低功率核磁共振成像仪,成本约为22000美元。
核磁共振成像(MRI)仪利用强磁场和无线电波来排列和操纵体内的氢原子,从而产生内部结构和器官的详细图像。磁铁的强度是以特斯拉(T)为单位来衡量的,传统的核磁共振成像需要强大的电磁铁,这些电磁铁的导线浸泡在过冷的液态氦中,以产生 1.5T - 7T 的磁场。
核磁共振成像仪需要大量电力输入,远远超出了标准墙壁插座所能提供的功率,而且必须安装在无线电频率屏蔽室内,以防止设备受到干扰。目前临床使用的核磁共振成像仪价格高达数百万美元。
相比之下,Zhao团队开发的全身核磁共振成像仪使用的是无氦0.05T磁铁,所需功率仅为1800瓦,与吹风机相当,这意味着它可以使用标准插座。更重要的是,它不需要无线电屏蔽。
5.改写细胞死亡法则?Science:发现癌细胞死亡的新途径——SLafen1基因
doi:10.1126/science.adh7950
在抗癌战役的漫长征途中,化疗作为传统武器,其斩杀癌细胞的机制似乎藏匿着未解之谜。荷兰癌症研究所的Thijn Brummelkamp及其同事们发现了一种全新的癌细胞死亡方式:由 Schlafen11 基因导致。相关研究结果发表在2024年5月17日的Science期刊上,论文标题为“DNA damage induces p53-independent apoptosis through ribosome stalling”。
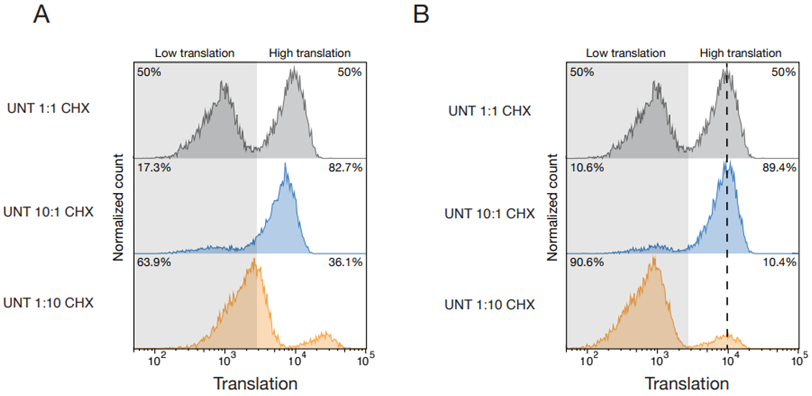
图片来自Science, 2024, doi:10.1126/science.adh7950
“这是一个非常出人意料的发现。癌症患者接受化疗已有近一个世纪的历史,但这种细胞死亡途径以前从未被观察到。患者在何时何地出现这种情况还需要进一步研究。这一发现最终可能会对癌症患者的治疗产生影响。”
许多癌症治疗方法都会损伤细胞 DNA。在受到过多无法弥补的损伤后,细胞会自行死亡。高中生物学告诉我们,p53 蛋白负责这一过程。p53 确保修复受损的 DNA,但当损伤变得过于严重时,就会启动细胞自杀。这可以防止细胞分裂失控和癌症形成。
6.Science:揭示Cachd1与Wnt受体相互作用,调节斑马鱼大脑的左右不对称性
doi:10.1126/science.ade6970
在一项新的研究中,来自英国伦敦大学学院、维康桑格研究所、剑桥大学和其他研究机构的研究人员对大脑独特的左右差异背后的遗传机制有了更好的了解,从而为更好地理解大脑不对称导致的人类疾病铺平了道路。相关研究结果发表在2024年5月3日的Science期刊上,论文标题为“Cachd1 interacts with Wnt receptors and regulates neuronal asymmetry in the zebrafish brain”。
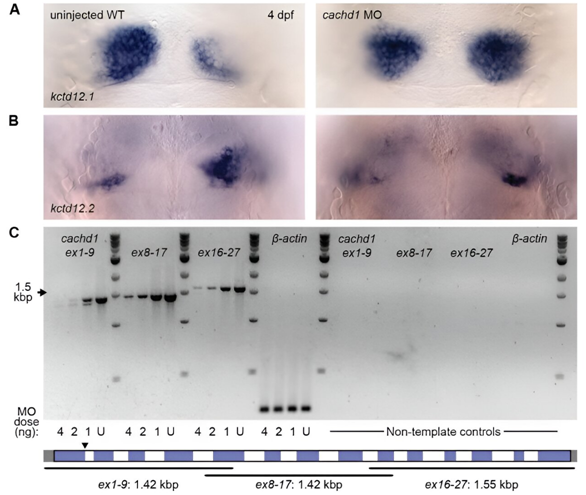
图片来自Science, 2024, doi:10.1126/science.ade6970
这些作者发现一种名为Cachd1的蛋白在建立大脑两侧不同的神经线路和功能方面起着至关重要的作用。通过在斑马鱼身上进行遗传筛选实验,他们发现当Cachd1发生突变时,大脑的右半部失去了正常的不对称发育,转而与大脑的左半部相仿。这种破坏导致神经线路异常,从而影响大脑功能。
这一发现揭示了大脑不对称的遗传机制,包括人类在内的许多动物物种都存在大脑不对称现象。了解这些过程可能为更好地理解大脑不对称导致的人类疾病(比如精神分裂症、阿尔茨海默病和自闭症谱系障碍)铺平道路。
7.一立方毫米奇迹!Science:科学家解锁人脑微观宇宙,新型人类大脑图谱包含此前从未见过的详细结构细节
doi:10.1126/science.adk4858
一立方毫米的脑组织听起来可能不多,但在这一立方毫米的微小空间里,包含了5.7万个细胞、230毫米血管和1.5亿个突触,总计1400万亿字节(terabytes)的数据,来自哈佛大学和谷歌公示的科学家们就完成了这一创举,相关研究成果“A petavoxel fragment of human cerebral cortex reconstructed at nanoscale resolution”发表在了Science杂志上。
文章中,研究人员通过联合研究创建了迄今为止最大的突触分辨率、人类大脑的3D重建结构,从而生动详细地展示了仅有半个米粒大小的人类颞叶皮层中每个细胞及其神经连接网络的细节信息。研究人员将Lichtman电镜成像技术与人工智能算法相结合,对哺乳动物大脑中较为复杂的线路布局进行色彩编码和重建。

新型人类大脑图谱或包含此前从未见过的详细结构细节。
图片来源:Science (2024) DOI:10.1126/science.adk4858
研究人员的最终目标是绘制出小鼠全大脑神经连接线路的高分辨率图谱,其数据量相当于他们从这一立方毫米的人类大脑皮层碎片中所获得数据量的1000倍。
Lichtman教授表示,“碎片”这个词语或许具有一定的讽刺性,但对于大多数人而言,1万亿字节是非常巨大的,但人脑的一部分碎片(仅仅是人类大脑中很小很小的一部分)就含有数千万亿字节的信息量。
8.Science:我国科学家揭示人类癌症中肿瘤浸润B细胞的图谱
doi:10.1126/science.adj4857
在一项新的研究中,来自中国科学院上海免疫与感染研究所、复旦大学和浙江大学的研究人员揭示了肿瘤浸润B细胞的两种应答模式,具有治疗意义。相关研究结果发表在2024年5月3日的Science期刊上,论文标题为“A blueprint for tumor-infiltrating B cells across human cancers”。
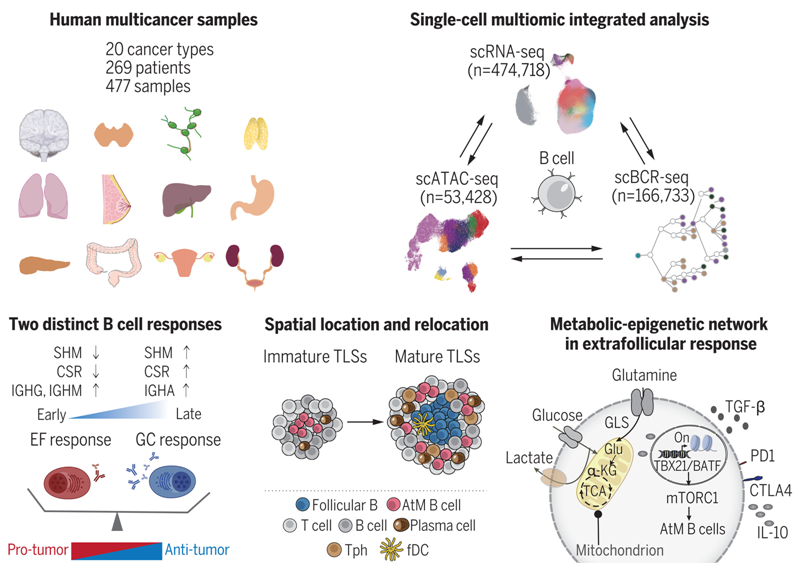
对人类泛癌B细胞图谱的系统分析
图片来自Science, 2024, doi:10.1126/science.adj4857
长期以来,B细胞一直被认为是肿瘤浸润淋巴细胞的重要组成部分,但它们在抗肿瘤免疫中发挥的是积极作用还是消极作用却存在很大争议。在这项研究中,这些作者通过对20种癌症类型中的B细胞进行全面的单细胞多组学分析,将肿瘤浸润B细胞反应分为生发中心(germinal center, GC)样和滤泡外(extra-follicular, EF),并根据癌症类型偏好进行分类。
他们发现,EF B细胞反应与免疫抑制性肿瘤微环境(TME)和不良预后有关。相比之下,GC样B细胞反应则与抗肿瘤免疫力强和预后良好有关。此外,通过大量分析,这些作者确定了非典型记忆(atypical memory, AtM)B细胞(又称年龄相关B细胞)的分子特征和分化途径,这是EF B细胞反应的关键角色。耐人寻味的是,他们发现谷氨酰胺代谢可以促进AtM B细胞的分化,而这些激活的AtM B细胞会抑制T细胞功能并促进调节性T细胞(Treg)分化。
9.Science:利用AlphaFold2结构预测可指导潜在的候选药物发现
doi:10.1126/science.adn6354
AlphaFold2 是一种预测蛋白结构的人工智能系统,它使科学家们能够识别并创造出几乎无穷无尽的候选药物,用于治疗神经精神疾病。然而,最近的研究对 AlphaFold2 在配体结合位点建模方面的准确性提出了质疑。配体结合位点是蛋白上药物附着并开始在细胞内传递信号以产生治疗效果的区域,也是可能产生副作用的区域。
在一项新的研究中,北卡罗来纳大学医学院药理学教授Bryan Roth博士与加州大学旧金山分校、斯坦福大学和哈佛大学的同事们确定了 AlphaFold2 可以产生配体结合结构的准确结果。相关研究结果于2024年5月16日在线发表在Science期刊上,论文标题为“AlphaFold2 structures guide prospective ligand discovery”。
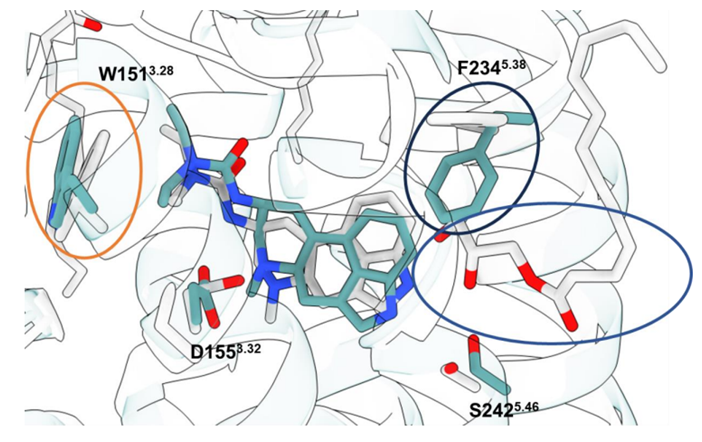
图片来自Science, 2024, doi:10.1126/science.adn6354
Roth说,“我们的研究结果表明,AlphaFold2 结构可用于药物发现。要想创造出能击中预期靶点来治疗疾病的药物,几乎有无限的可能性,这种人工智能工具可以说是无价之宝。”
10.Science:新型基因递送载体有望用于治疗人类大脑疾病
doi:10.1126/science.adm8386
在一项新的研究中,来自布罗德研究所的研究人员向更有效的脑疾病基因疗法迈出了重要的一步,他们设计出了一种基因递送载体:它利用一种人类蛋白有效地穿过血脑屏障,将与疾病相关的基因递送到表达这种人类蛋白的小鼠的大脑中。他们指出,由于这种载体与血脑屏障中一种经过充分研究的蛋白结合,因此很有可能在患者身上发挥作用。相关研究结果于2024年5月16日在线发表在Science期刊上,论文标题为“An AAV capsid reprogrammed to bind human transferrin receptor mediates brain-wide gene delivery”。

图片来自Science, 2024, doi:10.1126/science.adm8386
基因疗法有可能治疗一系列严重的遗传性脑部疾病,这些疾病目前还没有治愈的方法,治疗方案也很少。但是,美国食品药品管理局(FDA)批准的用于包装和向靶细胞递送这类基因疗法的最常用载体——腺相关病毒(AAV),并不能有效地高水平穿过血脑屏障并递送治疗性货物。
血脑屏障是一层具有高度选择性的膜,将血液与大脑隔开,要使治疗性货物通过血脑屏障是一个巨大的挑战,几十年来它一直阻碍着更安全、更有效的脑疾病基因疗法的开发。
在这项新的研究中,在布罗德研究所载体工程高级主任Ben Deverman的领导下,这些作者对第一种已发布的AAV进行改造,使之在人源化小鼠体内靶向一种人类蛋白,从而能够进入大脑。这种 AAV 与在人类血脑屏障中高度表达的人类转铁蛋白受体结合。
这些作者发现当把他们的AAV注射到表达人源化转铁蛋白受体的小鼠血液中时,它进入大脑的水平远远高于用于FDA批准的中枢神经系统基因疗法中的AAV——AAV9。
它还能进入大部分重要类型的脑细胞,包括神经元和星形胶质细胞。他们随后证实他们的 AAV 可以将 GBA1 基因拷贝递送到整个大脑的大部分细胞,而 GBA1 基因与戈谢病(Gaucher's disease)、路易体痴呆症和帕金森病有关。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


