Cell:皮肤伤口修复的必经之路:组织流动性的动态调控
来源:生物探索 2024-09-21 10:06
本研究通过开发新型动物模型和分析方法,阐述了皮肤伤口修复过程中,组织流动性的改变激活干细胞EGFR/AP1信号通路,从而增强干细胞增殖能力,补充细胞损失,提高伤口局部细胞浓度,从而完成修复。
皮肤表皮是一种高度分隔的组织,由毛囊 (hair follicles, HF)及其周围的毛囊间表皮 (interfollicular epidermis, IFE)组成。成熟的IFE由一层表达K14(keratin 14)的基底细胞(basal layer)和多层终末分化的上基底细胞层构成。正常生理条件下,表皮干细胞(stem cells, SCs)通过不对称自我更新方式生成新的SCs和具有分化潜能的前体细胞,维持着SCs增殖分化和外层细胞不断脱落的动态平衡。表皮作为与人体外界接触的第一道防线,出现损伤是无法避免的,所以,表皮内的SCs能够快速反应、增殖、修复并重新建立组织结构就显得尤为重要【1】。然而,由于缺乏合适的皮肤损伤模型,SCs在修复过程中是如何被激活、如何快速恢复细胞内稳态的研究进展缓慢,相关机制也并不清楚。
为了更好的研究SCs在皮肤损伤中的作用和调控机制,近日,来自比利时布鲁塞尔自由大学的Cedric Blanpain团队在Cell上发表了文章Dynamic regulation of tissue fluidity controls skin repair during wound healing,开发了一种能够特定损伤基底细胞层的动物模型,通过使用谱系示踪、共聚焦、活体成像、RNA测序等技术,对表皮伤口修复(wound healing)再生过程中SCs和组织的动态变化进行了探索。研究发现,基底细胞层损伤后,细胞数量下降,原本紧实类固态的(solid-like)稳定环境变得松散,细胞组织结构进行重新分布,这种类液态的(fluid-like)环境能够激活SCs内EGFR/AP1信号轴,使得干细胞进行快速增殖,迅速提高细胞浓度,进行再上皮化(re-epithelialization),恢复类固态稳定的环境。

IFE内SCs更新能力增强以促进表皮伤口修复
既往的皮肤损伤模型通常造成皮肤的大面积损伤,引起出血和严重的炎症反应,使得再生能力下降,并给干细胞动态研究增加很多变量,无法进行准确追踪。该研究使用K14rtTA/TetO-DTA x K14CREER/Rosa-confetti工程鼠,通过表皮涂抹doxyclycline(DOX)诱导基底细胞死亡,Tamoxifen(TAM)处理对基底细胞进行追踪。研究发现,该模型能够特定诱导基底细胞层的组织损伤,而不影响表皮整体结构和上层分化细胞稳态;损伤后1-4天内看到大量细胞增殖并在第4天达到峰值,之后逐渐降低直至11天重新回到稳态。通过克隆追踪和组织染色等方法对1-11天样本进行分析发现,组织再生过程伴随克隆数(clone size)的逐渐增多,相较于11天的对照组样本,平均基底克隆大小增大14倍,由此说明基底细胞死亡诱导干细胞由不对称分裂(asymmetrical division)到对称分裂(symmetrical division)的瞬时变化,从而实现克隆扩增。
表皮伤口修复中的动态变化描述: 组织流动性
通过动物实验研究人员发现,在皮肤再生过程中,细胞浓度和面积有很大的改变,猜测SCs的激活可能和局部细胞浓度、细胞间物理接触有一定相关性。由此,研究人员采用计算细胞空间变化和预测组织机制的Voronoi model【2】进行分析。研究首先假设这种动态变化是基于浓度改变的一种反馈机制: 即局部细胞浓度降低时,干细胞进入对称分裂复制过程直到达到原有稳态浓度,反之则进入不对称分裂,降低增值速度,产生分化细胞。通过计算模拟发现确实如此,细胞死亡后初期,细胞重编排能力增强,细胞分裂能力提高,提示基底层内存在组织流动性(fluidity)的动态变化。
接下来,研究人员将上述模型预测的结果在动物模型内进行进一步验证。组织流动性(tissue fluidity)【3】通常使用细胞重排率进行描述(degree of cellular rearrangements),这里用T1 transitions的频率(frequency of T1 transitions)为参数进行细胞重排率计算,T1 transition速率(rate)越高,组织内机械压力也就越大,组织结构就更偏向类液态环境(Figure 1A B)。通过对皮肤修复过程中不同时间点的组织进行分析后发现,修复早期T1 transitions升高,在第2天达到高峰,之后逐渐下降,11天恢复和control动物一致 (Figure 1D)。该研究证实在皮肤修复过程中存在组织流动性的动态变化,这种变化和SCs分裂相关。
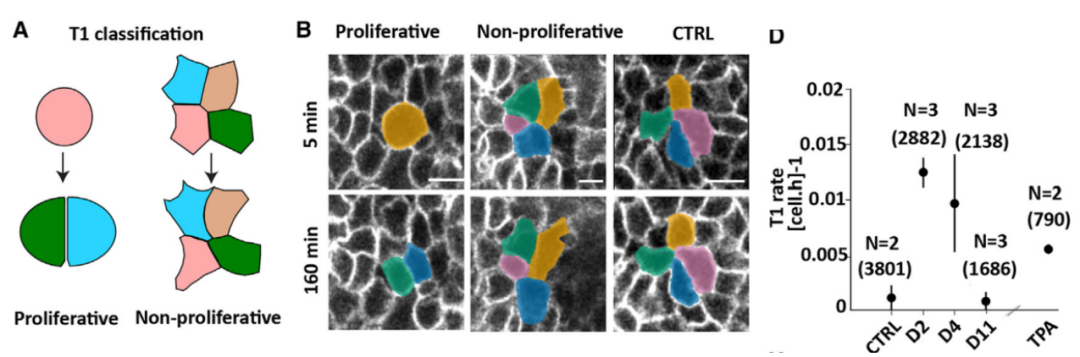
Figure 1. T1 transition rate.(Credit: Cell)
表皮伤口修复过程的分子机制研究
接下来,研究人员对不同时间点的组织进行转录水平测序、单细胞水平和表观遗传分析发现,epiregulin表达、EGFR激活和Jun表达在细胞损伤后第2天开始上调,在第4天达到峰值,之后逐渐下调,这和之前观测到的动态变化保持一致。同时,研究人员在表皮损伤后使用ErbB家族抑制剂afatinib、MEK家族抑制剂trametinib和Jun家族AP1抑制剂T-5224对动物模型进行处理,结果显示这些抑制剂都能够抑制干细胞激活和扩增,加速损伤进程,由此证明EGFR/MARK/AP1信号轴在干细胞促进修复过程中的重要作用。
总的来说,本研究通过开发新型动物模型和分析方法,阐述了皮肤伤口修复过程中,组织流动性的改变激活干细胞EGFR/AP1信号通路,从而增强干细胞增殖能力,补充细胞损失,提高伤口局部细胞浓度,从而完成修复。该研究为研究皮肤干细胞功能和再生机制提供了新的思路。
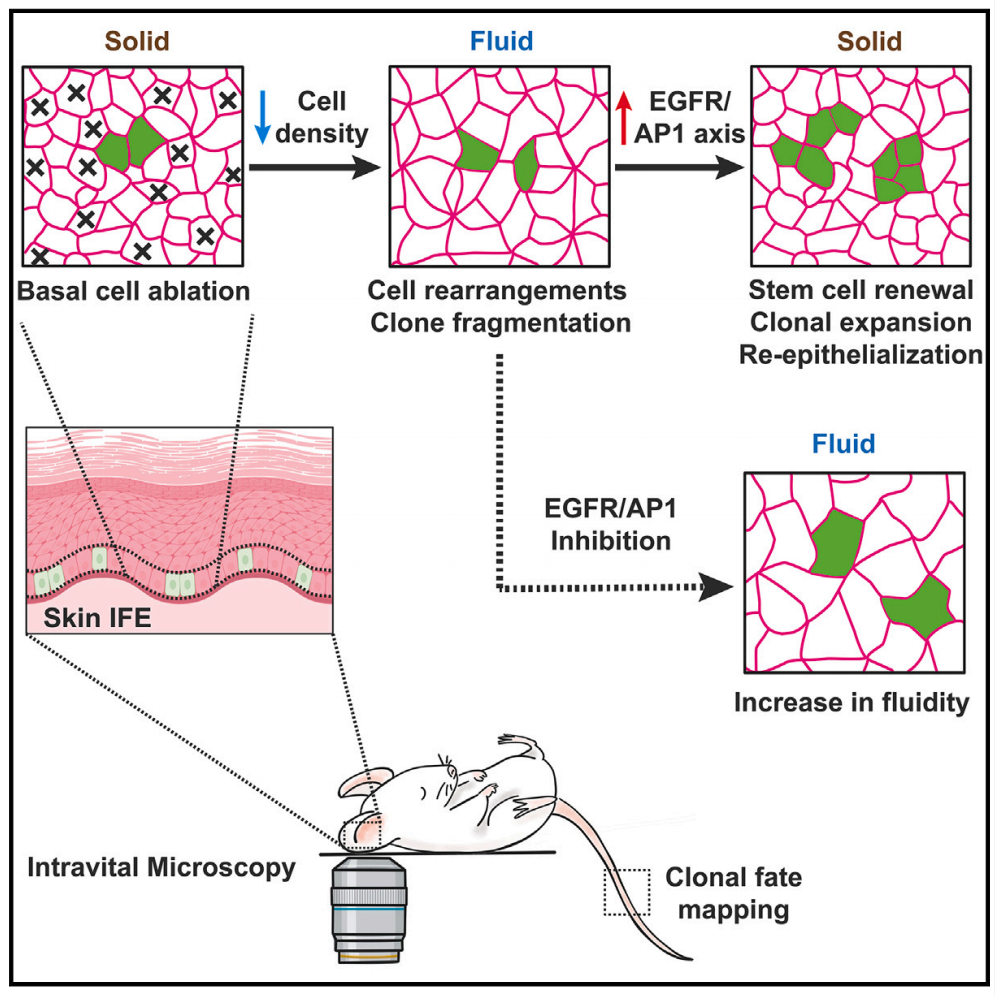
模式图(Credit: Cell)
参考文献:
1. Dekoninck,S., andBlanpain, C.(2019).Stemcelldynamics, migrationand plasticity during wound healing. Nat. Cell Biol. 21, 18–24.
2. Alt, S., Ganguly, P., and Salbreux, G. (2017). Vertex models: from cell me chanics to tissue morphogenesis. Philos. Trans. R. Soc. Lond. B Biol. Sci. 372, 20150520.
3. Hannezo,E., andHeisenberg, C.-P. (2022). Rigidity transitions in develop ment anddisease. Trends Cell Biol. 32, 433–444.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


