Gut:上海交大/浙大团队共同揭示“点燃”胰腺癌免疫微环境的表观遗传治疗靶点!
来源:奇点糕 2024-09-06 14:37
在本次研究中,研究者们进行了专门的CRISPR-Cas9表观遗传体外筛选,结果显示,仅有敲除胰腺癌细胞的Med12,会在小鼠实验中显著影响成瘤速度和免疫微环境。
近日,上海交通大学医学院附属仁济医院薛婧、王宇团队与上海交大基础医学院唐玉杰,浙江大学王超尘等国内外研究者合作在Gut期刊发表的最新研究成果,就揭示了经由内源性逆转录病毒元件(Endogenous Retroelements,ERs)和表观遗传机制,对胰腺癌免疫抑制性微环境有重要调控作用的靶点MED12,它可能是免疫治疗攻破胰腺癌的全新突破口!
研究者们借助CRISPR-Cas9筛选出具有强力免疫抑制效应的MED12后,揭示了MED12的具体作用机制:MED12可稳定异染色质蛋白1A(HP1A),使其抑制H3K9me3标记的ERs,而Med12缺失所导致的逆转录转座子去抑制,会激活人体内经典的、由胞质核酸感知通路激活的固有免疫应答,使胰腺癌免疫微环境变为利于免疫治疗的炎症型(Inflamed),为免疫治疗铺平道路。

论文首页截图
相信各位都知道胰腺癌的肿瘤微环境有多么让免疫治疗绝望,奇点糕就不用铺垫了,直接快进到发现MED12靶点的环节吧?从表观遗传的角度入手,此前在胰腺癌中还不算多,但借助ERs破局倒真不是什么异想天开,早先就有学者撰文提出,在肿瘤、自身免疫疾病等不同的应用场景中,ERs可能诱导的免疫应答各不相同,有些或许就可利用[1]。
在本次研究中,研究者们进行了专门的CRISPR-Cas9表观遗传体外筛选,而在筛选出的多个影响胰腺癌抗肿瘤免疫应答的调控因子中,仅有敲除胰腺癌细胞的Med12,会在小鼠实验中显著影响成瘤速度和免疫微环境;且在免疫健全小鼠身上,敲除Med12会使肿瘤微环境内浸润的CD8+T细胞、NK细胞和NKT细胞数量大增并功能增强,免疫微环境整体呈炎症型表现,利好免疫治疗。
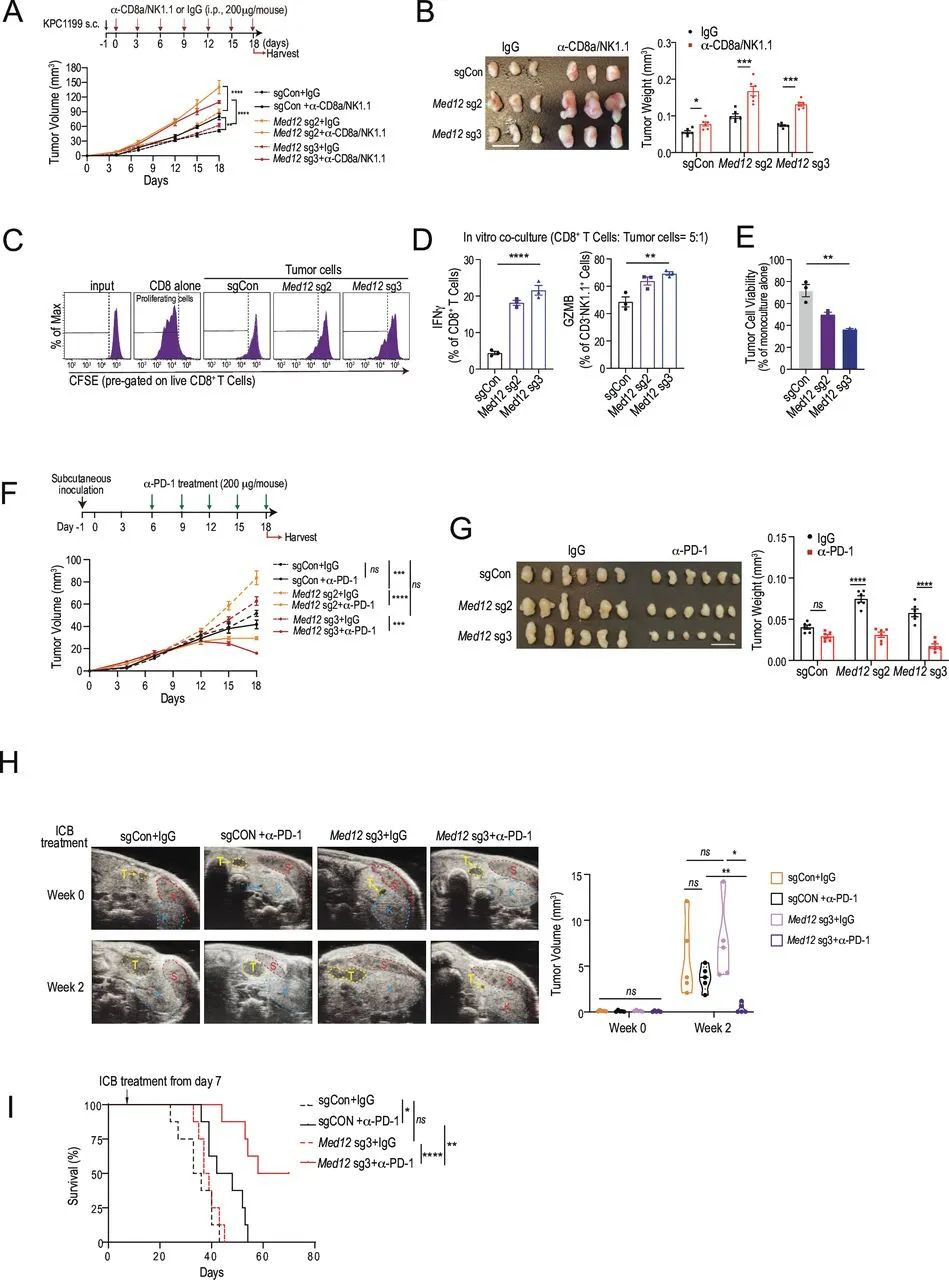
敲除Med12使胰腺癌免疫微环境转变为炎症型,利好此前束手无策的免疫治疗
做到这一步当然还不够,知其然要知其所以然嘛,于是研究者们开始探索敲除Med12增敏免疫治疗的具体机制。基因集富集分析(GSEA)首先提示,敲除Med12后表达上调的基因主要与内源性抗原肽处理和呈递(由MHC-I类分子进行)有关,同时还有NF-κB和干扰素-α通路相关基因的显著富集,到这里的发现还算是意料之中。
但接下来,研究者们在敲除Med12的胰腺癌细胞内意外发现了大量的内源性双链DNA(dsDNA),同时细胞内感知dsDNA/RNA的关键基因表达也显著上调,意味着NF-κB和干扰素-α通路的激活,是由于dsDNA被胞质核酸感知通路察觉,拉响了外敌入侵的警报;而敲除Mda5、Ddx58两个胞质核酸感知通路中的关键基因,就会使敲除Med12激活的免疫应答消失。
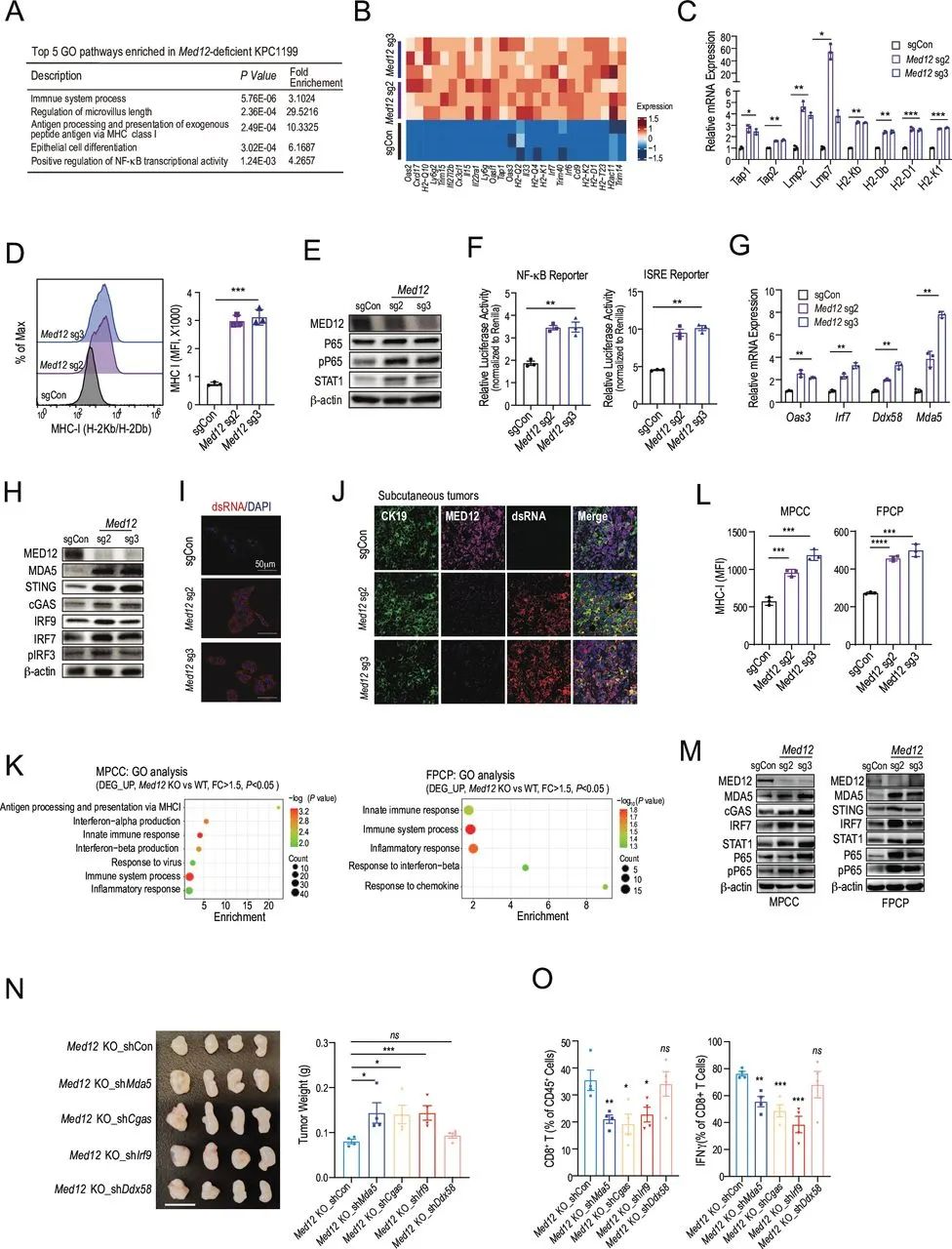
敲除Med12可经由胞质核酸感知通路,激活关键抗肿瘤免疫应答通路
而人体内dsDNA的主要来源,就是奇点糕一开始提到的“伏笔”——ERs,研究者们也通过染色体可及性测序(ATAC-seq)和RT-qPCR证实,敲除Med12激活了ERs,使其中逆转录转座子的染色质可及性增强;同时,敲除Med12也使HP1A蛋白的稳定性下降(MED12可直接结合它来增强稳定性),削弱了HP1A下游原本专门负责沉默逆转录转座子的H3K9me3调控强度。
此外研究者们还发现,敲除Med12上调了染色质上大部分转座子(TEs)部位的H3K27乙酰化修饰水平,这是逆转录转座子进入转录激活状态的原因,也解释了前面dsDNA的来源和胞质核酸感知通路激活,启动固有免疫通路的环节;与上述发现一致,人类胰腺癌患者的MED12蛋白或Med12 mRNA水平,也与免疫治疗应答和生存预后直接挂钩,说明MED12同时具有成为治疗靶点和Biomarker的潜力。
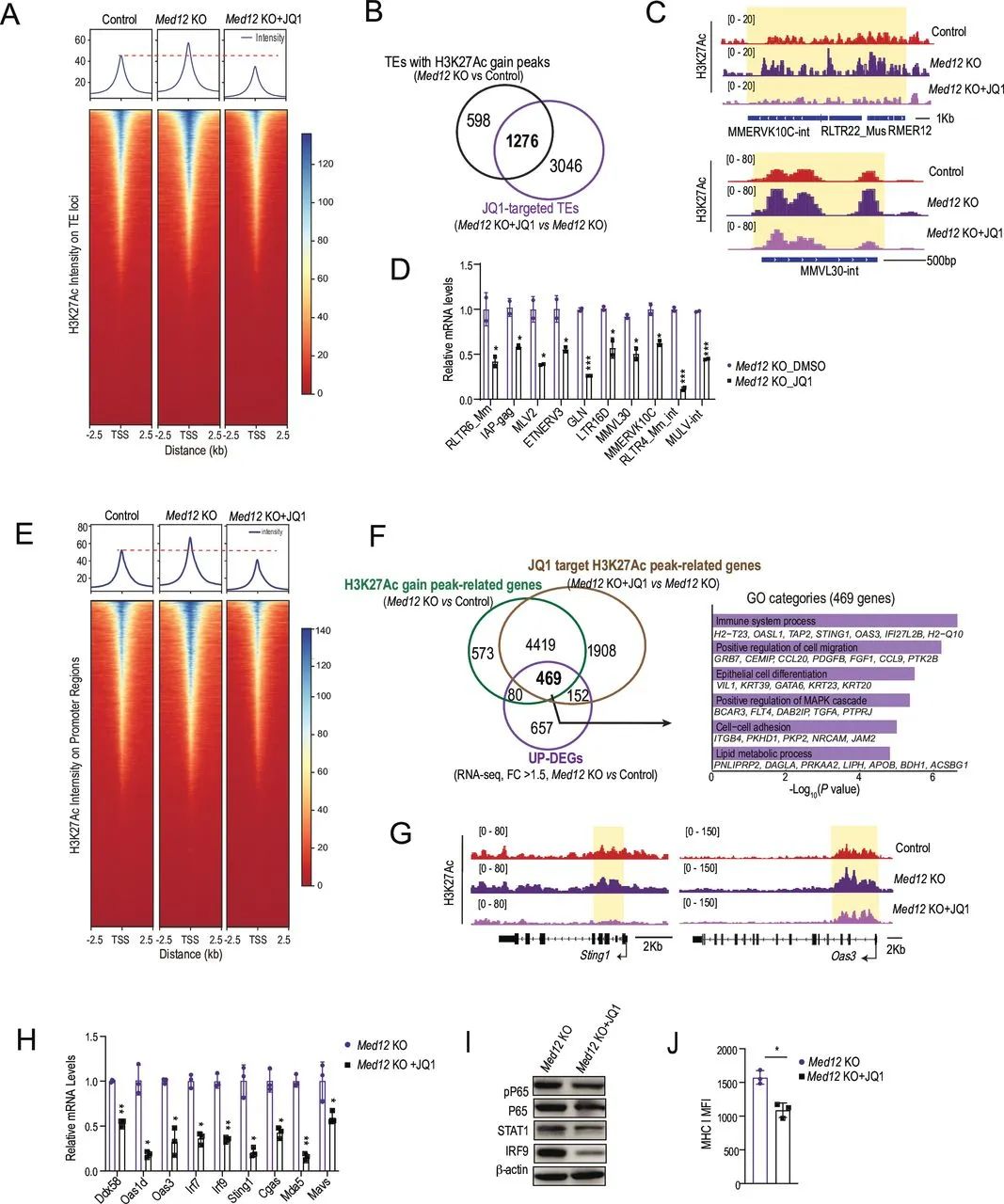
敲除Med12会增加转座子H3K27乙酰化修饰,以此激活免疫应答
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


