奇袭“癌王”!更适合中国胰腺癌患者的伊立替康脂质体诞生了,深度揭秘伊立替康脂质体(II)的创新之路
来源:奇点糕 2024-01-15 09:28
毫无疑问,此次盐酸伊立替康脂质体注射液(II)的获批,为中国胰腺癌患者的二线治疗增加了一款兼具疗效和安全性的新药物。
近日,由恒瑞医药研发的盐酸伊立替康脂质体注射液(II)获得中国国家药品监督管理局批准,用于联合氟尿嘧啶(5-FU)和亚叶酸钙(LV)治疗既往经吉西他滨为基础的化疗治疗失败的不可切除的局部晚期或转移性胰腺癌患者[1]。
该项审批是基于胰腺癌领域首个全中国人群,并获得阳性结果的Pan-Heroic-1研究。盐酸伊立替康脂质体注射液(II)联合方案的优异疗效和良好的安全性,离不开恒瑞医药自主研发的脂质体专利技术。
说起脂质体,很多人可能比较陌生,它是一种非常重要的药物载体,广泛应用于药物递送、基因工程、肿瘤诊疗等领域。大家一定还记得2023年的诺贝尔生理学或医学奖颁给了新冠mRNA疫苗的研发者[2],实际上mRNA疫苗能落地并摘得诺奖,脂质体厥功至伟。
那么如此厉害的脂质体是如何助力伊立替康对抗胰腺癌的呢?
这事儿咱们还得从60年前说起。
脂质体与伊立替康的相遇
脂质体最早由英国剑桥巴伯拉罕研究所的Alec Bangham于1962年在电子显微镜下发现[6]。六年后,正式被命名为脂质体[4,5]。
1976年,英国科学家Gregory Gregoriadis在《新英格兰医学杂志》上发表了两篇文章,系统阐述了脂质体作为药物载体的巨大价值[6-9]。1990年,全球第一个将脂质体作为载体的药物抗真菌两性霉素B脂质体(Ambisome B liposomal)在欧洲上市[10]。时至今日,以脂质体为载体的药物或疫苗已超过20种[10]。
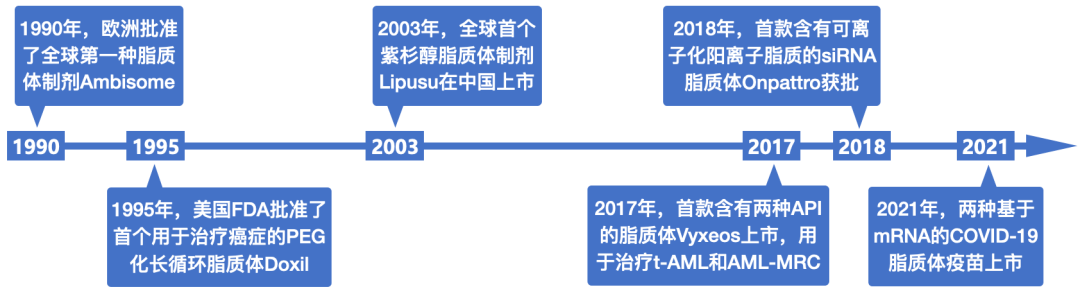
脂质体相关药物/疫苗获批的里程碑事件[10]
同样是20世纪60年代,具有抗癌活性的喜树碱被分离出来[11,12]。大约20年后,拓扑异构酶I被发现是喜树碱的靶点,科学家开始开发喜树碱衍生物,伊立替康应运而生[13]。
1994年开始,伊立替康先后在日本、欧洲和美国获批上市,用于治疗多种癌症。由于治疗效果优于吉西他滨,伊立替康联合奥沙利铂和5-FU/LV的FOLFIRINOX方案,成为转移性胰腺癌患者一线治疗的推荐方案[14]。考虑到安全性问题,FOLFIRINOX方案主要用于体能状况良好、可耐受的患者,临床上大部分患者采用的一线治疗方案还是吉西他滨。
如果患者在接受以吉西他滨为基础的治疗后出现进展,就面临“无药可用”的境地。伊立替康是胰腺癌二线治疗的潜在药物,然而伊立替康的毒副作用和不稳定性,大大地限制了伊立替康的使用。
为了解决上述问题,科学家们将目光投向与生物膜结构相似,可实现药物靶向递送,且具有良好生物相容性和可降解性的脂质体。2011年4月,恒瑞医药就提交了盐酸伊立替康脂质体注射液(II)的新药临床研究审批(IND)申请,开启了长达十余载的研发之路。
盐酸伊立替康脂质体注射液(II)的“三板斧”
盐酸伊立替康脂质体注射液(II)采用的是恒瑞医药的自主专利技术,药物的包封率>95%。超高的包封率,一方面可以降低游离伊立替康的毒性,另一方面可以防止伊立替康过早水解,保持伊立替康的抗癌活性,达到降低毒性,提高疗效的目的[15]。
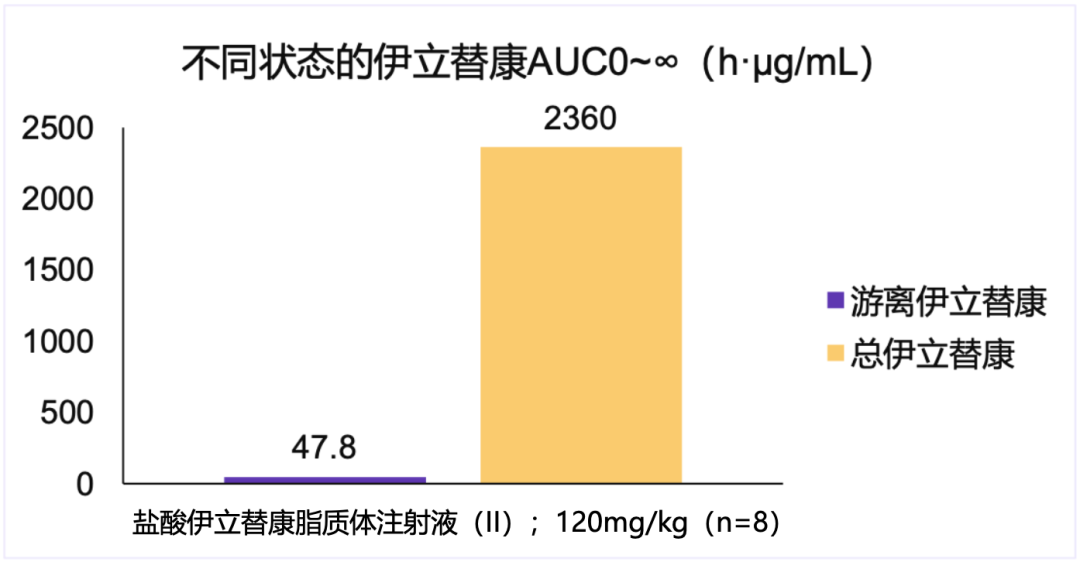
血浆中95%以上的药物被包封于脂质体中(数据由恒瑞提供)
尽管如此,要想让脂质体顺利送达肿瘤也并不容易。早在1971年,Gregoriadis团队就发现,经静脉注射的脂质体会被体内的网状内皮系统(RES)快速清除[16,17]。在当时,这被认为是脂质体药物走向临床应用过程中所面临的不可逾越的障碍[18]。
这个问题直到1990年才被解决。田纳西大学Leaf Huang团队发现,将聚乙二醇(PEG)链嫁接到脂质体表面,可以大大延长脂质体的循环时间[19]。从机制上讲,脂质体外层的PEG具有屏蔽作用,不仅可以阻止抗体捕获脂质体[20],还可以阻止脂质体与调理素结合,减缓脂质体被RES清除[21]。
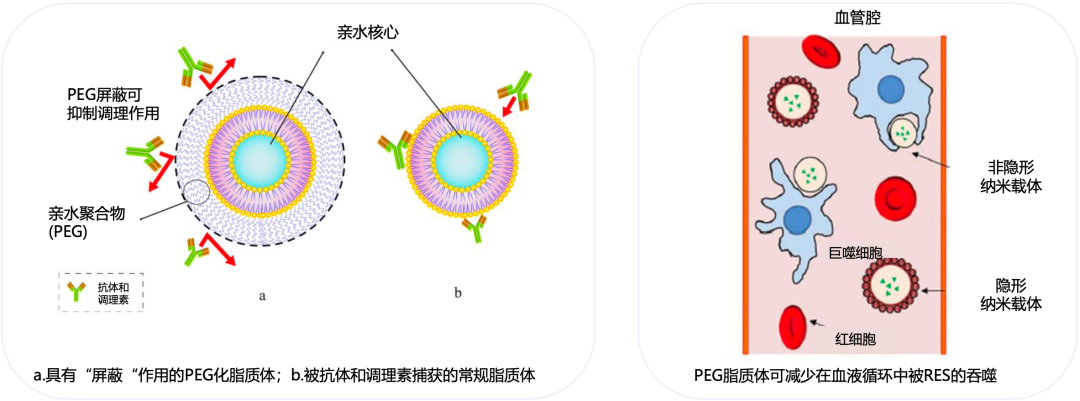
PEG的作用机制
盐酸伊立替康脂质体注射液(II)采用了进口的PEG磷脂膜表面修饰,有效地减少了脂质体被RES清除,延长了体内循环的时间。
药代动力学数据显示,与非脂质体包裹的盐酸伊立替康注射液相比,盐酸伊立替康脂质体(II)的清除率大幅降低,半衰期大幅提升。与同类型的脂质体剂型相比,二者在人体内的代谢数据基本相当;值得注意的是,盐酸伊立替康脂质体(II)的清除率更低,分布容积更小,这意味着它更能靶向肿瘤组织。
在降低人体对脂质体的清除这一点上,恒瑞医药的研究人员还在影响脂质体性能和安全性的另一个关键指标——粒径上下了大功夫。他们通过改变剂型,把盐酸伊立替康脂质体(II)的平均粒径控制在了100nm以下,改善其在体内和瘤内的分布和代谢,进而达到增效减毒的目的。
既往研究表明,粒径>200nm的脂质体主要被单核吞噬系统(MPS)清除[22],<10nm的颗粒往往被肾脏从循环中清除或渗入组织中,而20nm-200nm的颗粒主要经过RES清除[23]。因此,100nm的平均粒径可以避免MPS的清除,而PEG的修饰则进一步减少了RES的清除。
综上所述,超高包封率、PEG修饰和适中的粒径,是支撑盐酸伊立替康脂质体注射液(II)良好安全性和疗效的三块基石。
盐酸伊立替康脂质体注射液(II)的疗效
由中国药科大学附属南京天印山医院秦叔逵教授和上海交通大学医学院附属仁济医院王理伟教授牵头的Pan-Heroic-1研究是一项全国多中心、随机、双盲、对照III期临床研究,目的是探索HR070803[盐酸伊立替康脂质体(II)]联合5-FU/LV方案,用于二线治疗经吉西他滨治疗失败的局部晚期或转移性胰腺癌的有效性和安全性[25]。
2018年到2021年之间,一共有298名患者按照1:1的比例随机分配到盐酸伊立替康脂质体(II)联合5-FU/LV的试验组,或者安慰剂联合5-FU/LV的对照组。研究的主要终点是总生存期(OS),次要研究终点包括无进展生存期(PFS)、客观缓解率(ORR)和安全性等。
主要研究终点方面,伊立替康脂质体(II)组较安慰剂组的中位OS显著延长2.4个月(7.39个月 vs. 4.99个月,HR=0.63,P=0.0019),死亡风险降低了37%。
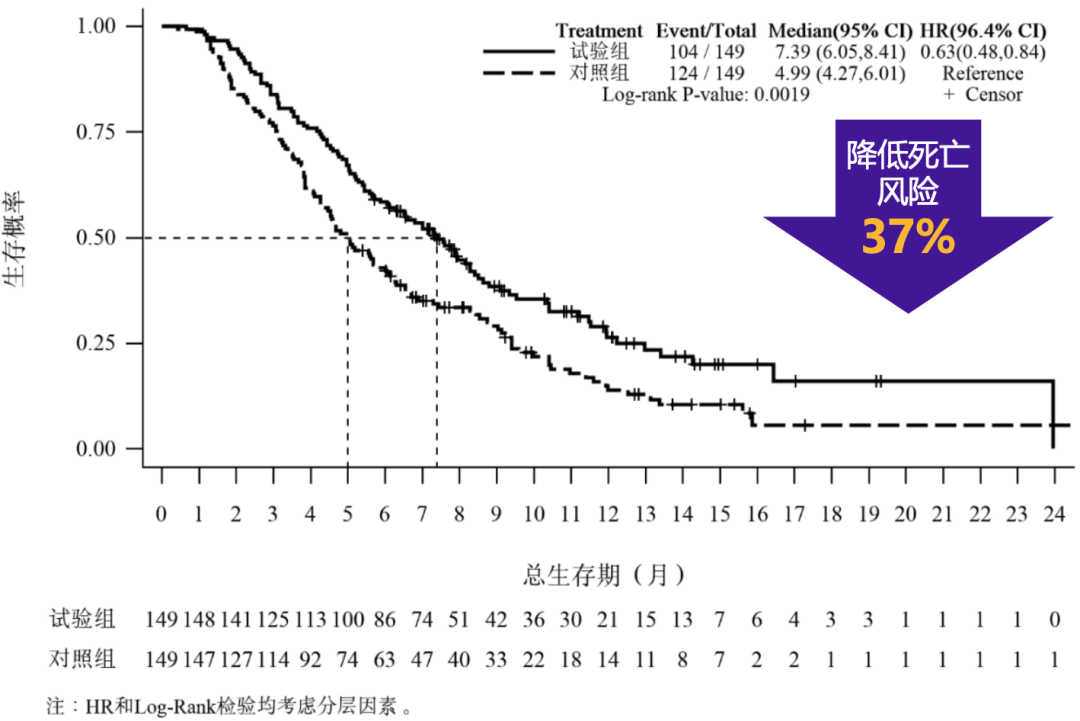
盐酸伊立替康脂质体注射液(II)将患者的死亡风险降低了37%
次要研究终点PFS,伊立替康脂质体(II)组相对安慰剂组显著延长了2.73个月(4.21个月 vs. 1.48个月,HR=0.36,P<0.0001),疾病进展和死亡风险降低64%。
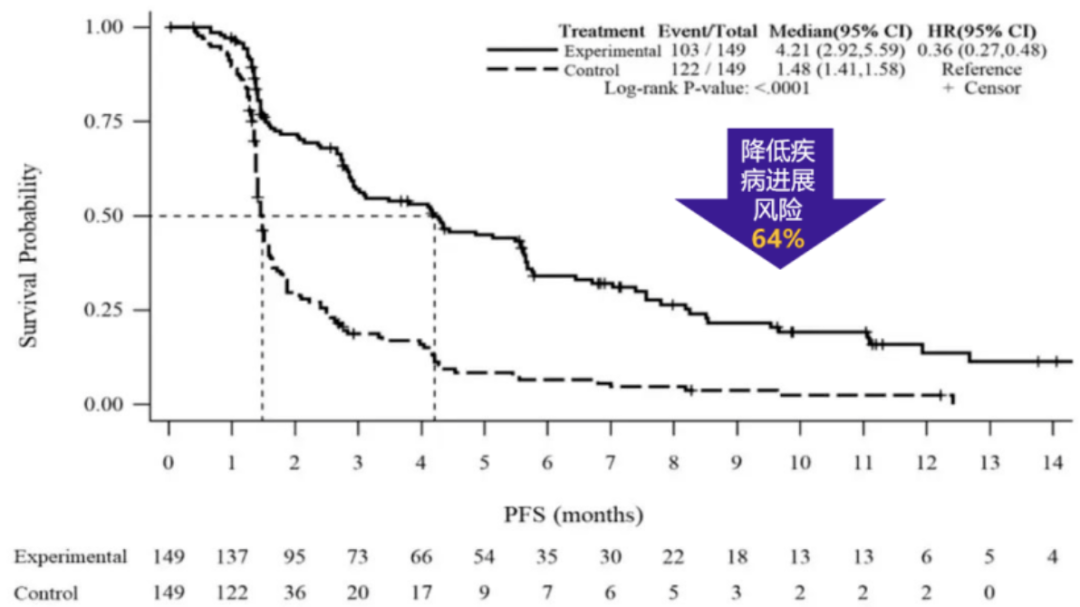
PFS数据
安全性数据方面,非头对头对比伊立替康注射液,伊立替康脂质体(II)出现3级及以上腹泻以及其他不良事件明显减少。
同源殊途:(II)型与其他伊立替康脂质体的不同之处
值得一提的是,从研发阶段开始,伊立替康脂质体(II)就与其他伊立替康脂质体有三大区别,使其更适合中国患者使用。
首先,伊立替康脂质体(II)与其他伊立替康脂质体制作处方工艺不一致。
其次,伊立替康脂质体(II)和其他伊立替康脂质体释放行为不一样。
最后,按照质量源于设计的理念,根据独特的药学设计,恒瑞的研究人员在脂质体(II)临床试验中探索出了与其他伊立替康脂质体不同的给药方案和剂量,更贴合中国人群的实际情况。
以上三点也是盐酸伊立替康脂质体注射液(II)的疗效和安全性三大助力。
总的来说,基于恒瑞医药的自主专利技术,具备超高包封率、PEG修饰和适中粒径三大特性的盐酸伊立替康脂质体注射液(II),在临床上表现出了优异的疗效和安全性。
毫无疑问,此次盐酸伊立替康脂质体注射液(II)的获批,为中国胰腺癌患者的二线治疗增加了一款兼具疗效和安全性的新药物。
参考文献:
[1].https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20240105153100136.html
[2].https://www.nobelprize.org/prizes/medicine/2023/summary/
[3].BANGHAM AD, HORNE RW. NEGATIVE STAINING OF PHOSPHOLIPIDS AND THEIR STRUCTURAL MODIFICATION BY SURFACE-ACTIVE AGENTS AS OBSERVED IN THE ELECTRON MICROSCOPE. J Mol Biol. 1964;8:660-668. doi:10.1016/s0022-2836(64)80115-7
[4].Sessa G, Weissmann G. Phospholipid spherules (liposomes) as a model for biological membranes. J Lipid Res. 1968;9(3):310-318.
[5].Deamer DW. From "banghasomes" to liposomes: a memoir of Alec Bangham, 1921-2010. FASEB J. 2010;24(5):1308-1310. doi:10.1096/fj.10-0503
[6].Allison AG, Gregoriadis G. Liposomes as immunological adjuvants. Nature. 1974;252(5480):252. doi:10.1038/252252a0
[7].Gregoriadis G, Neerunjun ED. Treatment of tumour bearing mice with liponsome-entrapped actinomycin D prolongs their survival. Res Commun Chem Pathol Pharmacol. 1975;10(2):351-362.
[8].Gregoriadis G. The carrier potential of liposomes in biology and medicine (first of two parts). N Engl J Med. 1976;295(13):704-710. doi:10.1056/NEJM197609232951305
[9].Gregoriadis G. The carrier potential of liposomes in biology and medicine (second of two parts). N Engl J Med. 1976;295(14):765-770. doi:10.1056/NEJM197609302951406
[10].He Y, Zhang W, Xiao Q, et al. Liposomes and liposome-like nanoparticles: From anti-fungal infection to the COVID-19 pandemic treatment. Asian J Pharm Sci. 2022;17(6):817-837. doi:10.1016/j.ajps.2022.11.002
[11].https://dtp.cancer.gov/timeline/noflash/profiles/Wani.htm
[12].Wall M E, Wani M C, Cook C E, et al. Plant antitumor agents. I. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from camptotheca acuminata1, 2[J]. Journal of the American Chemical Society, 1966, 88(16): 3888-3890.
[13].Grivicich I, Mans DR, Peters GJ, Schwartsmann G. Irinotecan and oxaliplatin: an overview of the novel chemotherapeutic options for the treatment of advanced colorectal cancer. Braz J Med Biol Res. 2001;34(9):1087-1103. doi:10.1590/s0100-879x2001000900001
[14].Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011;364(19):1817-1825. doi:10.1056/NEJMoa1011923
[15].Yang W , Yang Z , Fu J , et al. The influence of trapping agents on the antitumor efficacy of irinotecan liposomes: head-to-head comparison of ammonium sulfate, sulfobutylether-β-cyclodextrin and sucrose octasulfate. Biomater Sci. 2018;7(1):419-428. doi:10.1039/c8bm01175c
[16].Gregoriadis G, Ryman BE. Liposomes as carriers of enzymes or drugs: a new approach to the treatment of storage diseases. Biochem J. 1971;124(5):58P. doi:10.1042/bj1240058p
[17].Gregoriadis G, Leathwood PD, Ryman BE. Enzyme entrapment in liposomes. FEBS Lett. 1971;14(2):95-99. doi:10.1016/0014-5793(71)80109-6
[18].Weissig V. Liposomes Came First: The Early History of Liposomology. Methods Mol Biol. 2017;1522:1-15. doi:10.1007/978-1-4939-6591-5_1
[19].Klibanov AL, Maruyama K, Torchilin VP, Huang L. Amphipathic polyethyleneglycols effectively prolong the circulation time of liposomes. FEBS Lett. 1990;268(1):235-237. doi:10.1016/0014-5793(90)81016-h
[20].Rommasi F, Esfandiari N. Liposomal Nanomedicine: Applications for Drug Delivery in Cancer Therapy. Nanoscale Res Lett. 2021;16(1):95. Published 2021 May 25. doi:10.1186/s11671-021-03553-8
[21].Blume G, Cevc G. Molecular mechanism of the lipid vesicle longevity in vivo. Biochim Biophys Acta. 1993;1146(2):157-168. doi:10.1016/0005-2736(93)90351-y
[22].Liu P, Chen G, Zhang J. A Review of Liposomes as a Drug Delivery System: Current Status of Approved Products, Regulatory Environments, and Future Perspectives. Molecules. 2022;27(4):1372. doi:10.3390/molecules27041372
[23].Nong J, Glassman PM, Muzykantov VR. Targeting vascular inflammation through emerging methods and drug carriers. Adv Drug Deliv Rev. 2022;184:114180. doi:10.1016/j.addr.2022.114180
[24].https://clinicaltrials.gov/study/NCT05074589
[25].Wang L, Qin S, Zhou Y, et al. LBA61 HR070803 plus 5-FU/LV versus placebo plus 5-FU/LV in second-line therapy for gemcitabine-refractory locally advanced or metastatic pancreatic cancer: A multicentered, randomized, double-blind, parallel-controlled phase III trial (HR-IRI-APC)[J]. Annals of Oncology, 2022, 33: S1426. doi:10.1016/j.annonc.2022.08.063
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


