Nat Commun: 科学家揭示三阴性乳腺癌转移机制
来源:生物谷原创 2022-04-27 09:48
KMT5A介导的SNIP1 K301甲基化不仅是驱动c-MYC超活化和癌症转移的关键信号,而且还是TNBC患者预后不良的标志物。
乳腺癌是全球女性中诊断出的最普遍的癌症类型和致命的原发性恶性肿瘤。三阴性乳腺癌(TNBCs)占所有浸润性乳腺癌的约15%;由于缺乏受体,它们对内分泌靶向治疗不敏感。尽管对全身化疗有初步反应,但据报道,在被诊断为TNBCs的患者中,复发、转移和死亡的风险增加。因此,迫切需要更好地了解侵袭性表型和更高的转移潜力,以及识别分子靶标。越来越多的证据显示,在乳腺癌(包括TNBC)中,表观遗传结构失调,部分是由于翻译后修饰(PTMs)的异常模式。非组蛋白的赖氨酸甲基化则会影响修饰蛋白的生物学功能。而Smad核相互作用蛋白1(SNIP1)甲基化是否发生,并调节致癌信号传导,以及是否参与TNBC癌症转移,仍有待研究。

近日,复旦大学和兰州大学附属第一临床医学院的研究团队联合在Nat Commun上发表了一篇题为“KMT5A-methylated SNIP1 promotes triple-negative breast cancer metastasis by activating YAP signaling”的研究论文,具体研究了三阴性乳腺癌的发生和转移机制,并提出了一种赖氨酸甲基转移酶(KMT5A)甲基化依赖性调节机制,该机制使SNIP1具有致癌功能。
在本研究中,为了鉴定以甲基化依赖性方式调节的重要非组蛋白,研究人员使用特定的泛赖氨酸甲基化抗体对来自两个TNBC细胞系(即BT549和MDA-MB-231)的细胞裂解物进行基于质谱(MS)的筛选。结果显示,两种细胞系中都检测到了赖氨酸残基K301的甲基化,通过生成SNIP1突变体发现,SNIP1在Lys301处被甲基化。经证实,SNIP1甲基化可能促进TNBC在体外和体内的生长和转移。进一步研究发现,SNIP1是赖氨酸甲基转移酶KMT5A的非组蛋白底物,其经历KMT5A介导的单甲基化以促进乳腺癌细胞的生长,侵袭和肺转移。
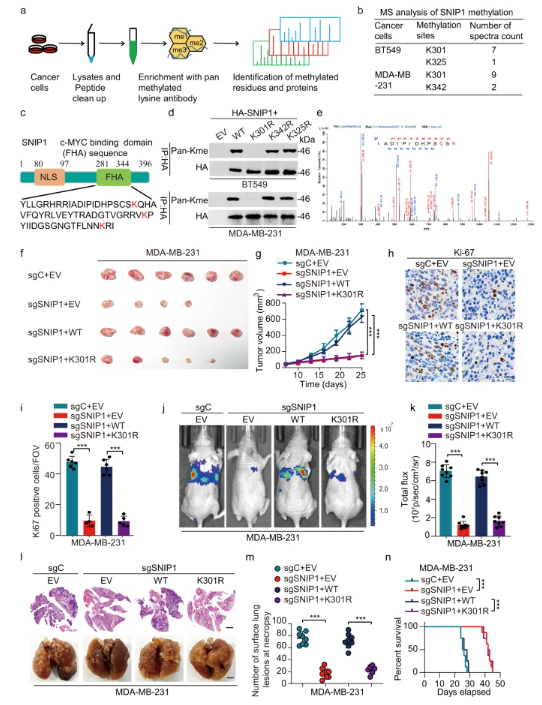
图 SNIP1甲基化促进其致癌功能
机制上,研究显示KMT5A介导的SNIP1的K301甲基化代表了释放组蛋白乙酰转移酶KAT2A的感应信号,并促进c-MYC和KAT2A的相互作用,以及c-MYC/KAT2A复合物招募到c-MYC目标的启动子。这一事件最终抑制了Hippo激酶级联,通过转录激活MARK4来增强三阴性乳腺癌(TNBC)的转移。在TNBC异种移植动物体中,共同抑制KMT5A的催化活性和YAP可减弱乳腺癌的转移并增加生存率。
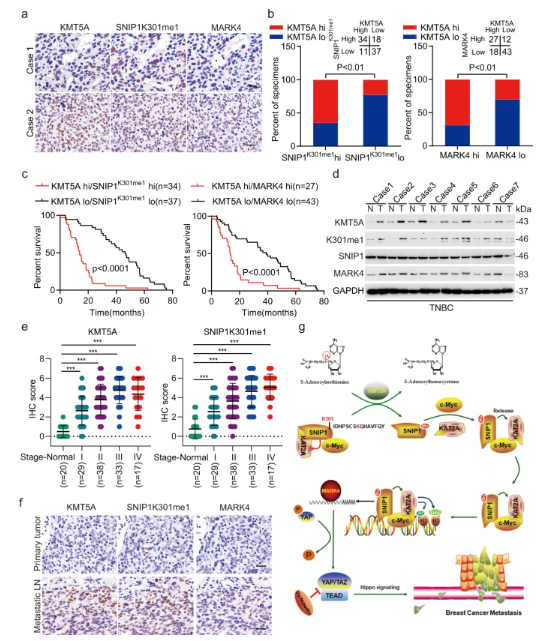
图 KMT5A表达与三阴性乳腺癌中激活的MARK4 / YAP信号传导显著相关
这项研究表明,KMT5A介导的SNIP1 K301甲基化不仅是驱动c-MYC超活化和癌症转移的关键信号,而且还是TNBC患者预后不良的标志物。这些发现增加了我们对SNIP1在癌症转移中的作用的理解。此外,这些结果为开发预防癌症转移的治疗策略提供了思路。
参考文献:Yu, B., Su, J., Shi, Q. et al. KMT5A-methylated SNIP1 promotes triple-negative breast cancer metastasis by activating YAP signaling. Nat Commun 13, 2192 (2022). https://doi.org/10.1038/s41467-022-29899-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


