Nature子刊:聂广军/赵潇团队使用细菌来源纳米囊泡增强肿瘤疫苗效果
来源:生物世界 2023-12-07 09:31
这些研究结果强调了基于OMV的纳米颗粒在诱导训练免疫以增强肿瘤疫苗免疫效果中的作用。这种免疫动员策略,利用来自细菌的天然纳米囊泡来改变基础固有免疫功能,是一种有前途的方法,可以积极引导疫苗诱导的适应性
国家纳米科学中心聂广军研究员、赵潇研究员团队在 Nature Nanotechnology 期刊发表了题为:Bacteria-derived nanovesicles enhance tumour vaccination by trained immunity 的研究论文。
训练免疫增强免疫细胞对后续感染或疫苗的反应性。该研究证明,使用含有大量病原相关分子模式(尤其是脂多糖)的细菌来源的外膜囊泡(OMV)进行预接种,可通过“训练免疫”来增强肿瘤疫苗的免疫治疗效果。

某些促炎性刺激物,例如β-葡聚糖、卡介苗、氧化低密度脂蛋白和尿酸,已被鉴定为训练免疫的诱导剂。这些刺激物对造血祖细胞的影响是间接的,主要通过白介素-1(IL-1)家族的细胞因子,特别是IL-1β来发挥作用。一些训练免疫诱导剂可以通过活化体内的炎症小体信号通路来引起IL-1β的分泌,最终导致骨髓造血祖细胞的表观重塑和谱系转移。
大多数炎症小体传感器,例如NLRP3、NLRC4和caspase-11,位于细胞质中。与自由刺激物相比,具有纳米结构的刺激物由于其更高的细胞内吞性和多种激活特性,可能诱导更强的炎症小体信号通路激活和IL-1β分泌,从而产生更强大的训练免疫。
外膜囊泡(OMV)是源自革兰氏阴性菌的天然纳米囊泡,由于其含有多种病原相关分子模式(PAMP),例如肽聚糖、脂多糖(LPS)和鞭毛蛋白,这些纳米囊泡具有激活固有免疫信号通路的强大能力。OMV也因此被认为是疫苗的佐剂和载体。
尽管OMV被哺乳动物细胞内吞并向胞浆内递送脂多糖(LPS)以触发caspase-11炎性小体,但OMV对训练免疫的潜在刺激作用仍未被充分探索。
在这项研究中,研究团队探讨了预先给药OMV诱导的训练免疫和随后肿瘤疫苗接种后的适应性免疫反应的影响。
研究团队发现,在肿瘤疫苗接种前1周,通过腹腔注射细菌来源的OMV,显著增强了小鼠的抗肿瘤免疫,其机制是OMV诱导了训练免疫,具体来说,细菌来源的OMV由于其天然的纳米结构,被内皮固有免疫细胞内吞,并伴随着病原相关分子模式(PAMP)递送进入细胞质,尤其是其中含有的脂多糖(LPS),从而激活了小鼠的炎症小体信号通路,诱导了白介素-1β(IL-1β)分泌,IL-1β进入骨髓引起造血祖细胞的谱系转移和表观重塑,最终使其分化后的外周抗原呈递细胞(APC)对后续肿瘤疫苗表现出免疫反应增强,并增加肿瘤抗原特异性T细胞的激活。
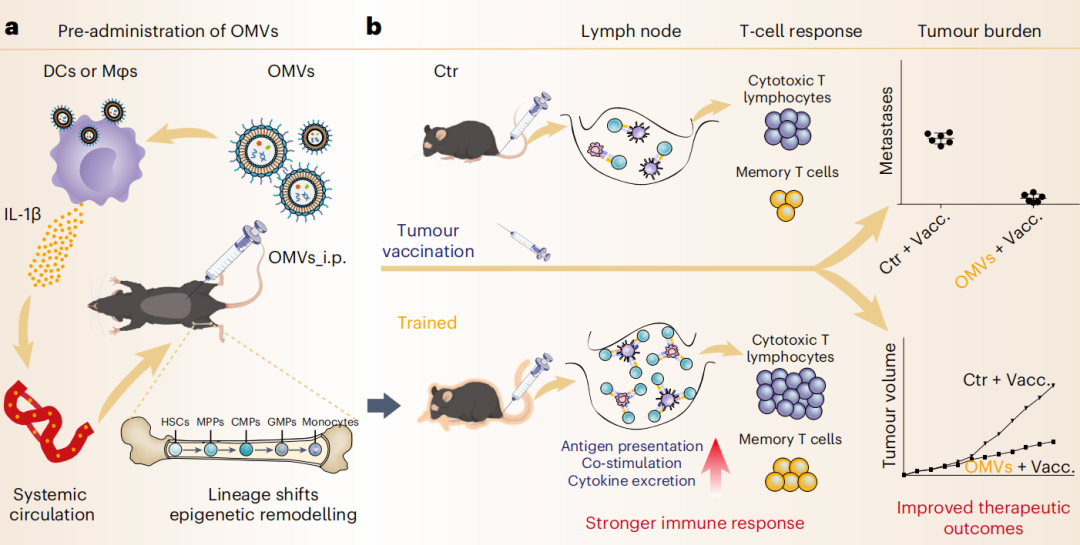
基于细菌来源纳米囊泡OMV的“围疫苗期”免疫预激策略与肿瘤疫苗增效
这些研究结果强调了基于OMV的纳米颗粒在诱导训练免疫以增强肿瘤疫苗免疫效果中的作用。这种免疫动员策略,利用来自细菌的天然纳米囊泡来改变基础固有免疫功能,是一种有前途的方法,可以积极引导疫苗诱导的适应性免疫反应。
国家纳米科学中心刘广娜博士、马娜娜博士、程科满博士为该论文共同第一作者,国家纳米科学中心赵潇研究员和聂广军研究员为该论文共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


