碱基编辑安全性新发现:腺嘌呤碱基编辑器引发染色体脱靶结构变异
来源:生物世界 2024-11-16 11:43
该研究为碱基编辑器的安全性评估提供了重要的科学依据,强调了在临床应用中需谨慎考虑脱靶结构变异的风险。
中国科学院脑科学与智能技术卓越创新中心孙怡迪研究组、周昌阳研究组与深圳农业基因组研究所左二伟研究组等合作,在 Genome Biology 期刊发表了题为:Adenine base editors induce off-target structure variations in mouse embryos and primary human T cells 的研究论文。
该研究揭示了腺嘌呤碱基编辑器(ABE)在小鼠胚胎和原代人T细胞中引发脱靶结构变异的现象。该研究为基因编辑技术的安全性提供了新的重要数据,或对未来的临床应用产生深远影响。

在这项研究中,研究团队通过全基因组测序和单细胞RNA测序等技术手段,开发了基于贝叶斯模型的高灵敏度脱靶检测方法,深入分析了腺嘌呤碱基编辑器(ABE)、CRISPR-Cas9和胞嘧啶碱基编辑器(CBE)在小鼠胚胎和人类T细胞中的脱靶效应。
结果显示,ABE和CRISPR-Cas9在小鼠胚胎中均引发了显著的脱靶结构变异,包括染色体缺失和易位等;而CBE引发的结构变异相对较少。在原代人T细胞中,使用ABE编辑后,有9.17%的细胞出现了染色体异常,而使用CRISPR-Cas9的这一比例更高,达到32.74%。更令人关注的是,这些染色体异常细胞在编辑后3周内仍然存在,提示了潜在的长期安全性风险(图1)。
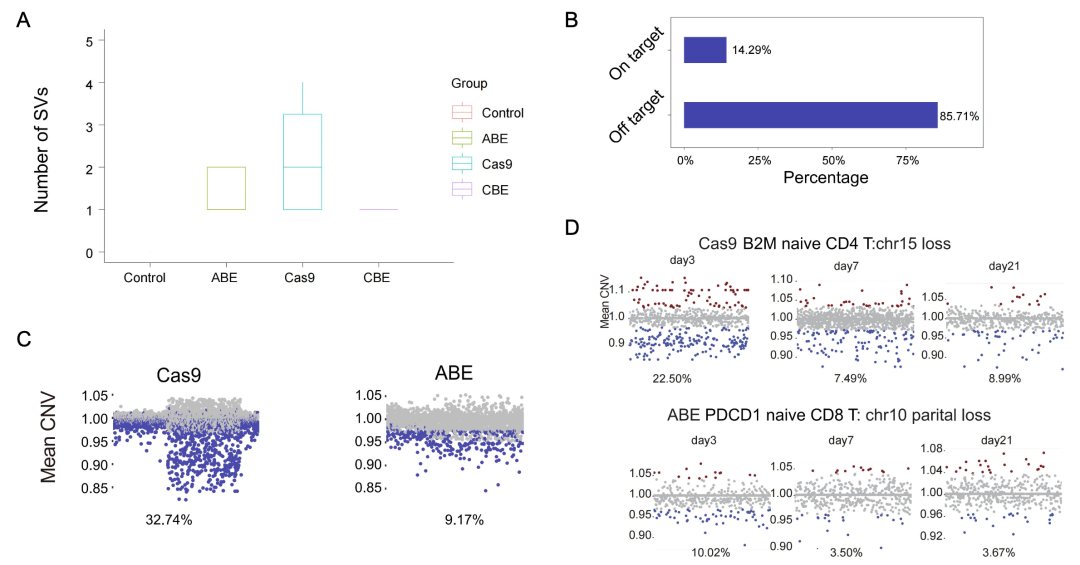
图1. ABE和CRISPR/Cas9在小鼠胚胎和人原代T细胞中引发脱靶结构变异。(A)ABE和CRISPR/Cas9在小鼠胚胎中引发脱靶结构变异。(B)靶向和脱靶位点大片段缺失的比例。(C)ABE和CRISPR/Cas9编辑细胞中产生染色体缺失的细胞比例。(D)ABE和CRISPR/Cas9编辑的T细胞亚类中发生染色体缺失的比例随时间变化的结果。
进一步分析表明,ABE引发的脱靶结构变异主要与其脱氨酶活性有关,而非单链向导RNA(sgRNA)的依赖性。这意味着传统的优化sgRNA序列的方法可能无法完全消除ABE的脱靶效应。
为了解决这一问题,研究团队尝试了高保真版本的ABE(ABE8e-V106W),结果发现脱靶效应显著降低,但仍未完全消除。
在功能影响方面,CRISPR-Cas9引发的染色体异常细胞中,p53和凋亡相关通路显著上调,可能导致细胞死亡。而ABE引发的异常细胞则表现出细胞周期相关基因的显著上调,细胞停滞在G0期,提示其对细胞增殖和功能可能产生影响。
总的来说,该研究为碱基编辑器的安全性评估提供了重要的科学依据,强调了在临床应用中需谨慎考虑脱靶结构变异的风险。研究团队呼吁,未来应进一步开发和优化高保真的基因编辑工具,以降低潜在的脱靶效应,确保基因编辑技术的安全应用。
中国科学院脑科学脑科学与智能卓越创新中心吴垒磊博士,益杰立科生物科技有限公司姜书谭博士和史梅松为论文共同第一作者。中国科学院脑科学与智能技术卓越创新中心孙怡迪研究员和周昌阳研究员、深圳农业基因组研究所左二伟研究员为论文共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


