GUT:复旦大学附属肿瘤医院团队,破解年轻结直肠癌肠菌及代谢物特征!
来源:奇点糕 2022-09-20 18:20
结直肠癌(CRC)是一种最常见的消化道恶性肿瘤。在我国,CRC是高发病率和高致死性癌症(分别排第二和第四位)[1]。
结直肠癌(CRC)是一种最常见的消化道恶性肿瘤。在我国,CRC是高发病率和高致死性癌症(分别排第二和第四位)[1]。
虽然老年CRC的发病率在持续下降,但是发病年龄在50岁之前的年轻CRC(也称早发性CRC)却呈现全球性的增长趋势[2, 3]。既往研究表明,年轻CRC不断攀升的发病率,与筛查在年轻人群中的推广没有关联[2]。
从临床特征上看,年轻CRC在发病部位、严重程度上都与老年CRC有差异[4]。大量的研究表明,肠道微生物与老年CRC之间存在关联[5, 6]。肠道微生物菌群及其代谢物,对老年CRC有较好的判别能力。
由于肠道菌群会随年龄变化[7],老年CRC研究中发现的标志物不一定适用于年轻CRC。
近期,复旦大学附属肿瘤医院马延磊团队,通过构建大型年轻和老年CRC的多组学队列,在粪便微生物宏基因组和代谢组水平,发现了年轻CRC特有的细菌物种、代谢物和酶基因;并基于粪便“细菌物种-代谢物-酶基因”标志物开发预测模型,进一步推动粪便多组学无创检测在CRC筛查中的应用。该成果发表在国际著名期刊Gut上[8]。

文章截图
去年,马教授团队就已在Nature Communications上发表年轻CRC与肠道菌群的关联研究,这是该领域的第一个大队列研究[9]。研究者通过疾病-对照的研究设计,发现年轻CRC关联的粪便微生物标志物有别于老年CRC。
肠道微生物对宿主的影响很可能是通过其分泌的代谢物,直接或间接地与宿主作用[10]。如果能找到微生物与宿主作用的代谢物,这将推进肠道微生物与CRC的机理研究。
为此,研究者继续采用疾病-对照的研究思路,总共招募了441位志愿者,包括114位年轻CRC患者(EO-CRC),100位年轻对照(EO-CRC);130位老年CRC患者(LO-CRC),97位老年对照(LO-Control)。研究人员给这些志愿者提供的粪便样品做了高通量宏基因组测序和高通量代谢组分析(图1)。
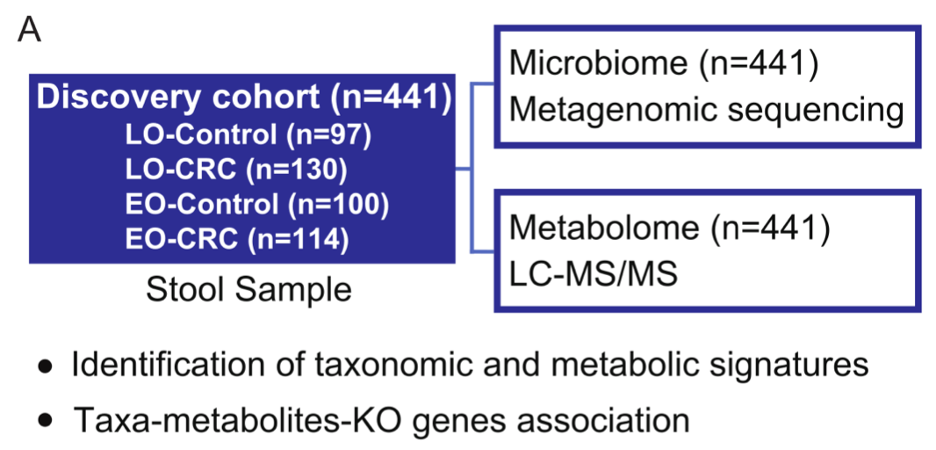
图1:文章中搭建的队列的组成和数据信息。
宏基因组分析显示,年轻和老年CRC患者的粪便微生物菌群谱都有别于健康对照(P=0.001)。研究者发现,年轻和老年CRC患者粪便菌群的多样性都显著低于健康对照(年轻P=0.0074;老年:P=0.0039)。
在细菌组成上,106个细菌物种的丰度在年轻CRC和年轻对照中有显著差异(P<0.05),335个细菌物种的丰度在老年CRC和老年对照中有显著差异(P<0.05)。
最为显著的信号是,年轻和老年CRC患者都缺乏丁酸盐合成菌,如普拉梭菌(F. prausnitzii)、直肠真杆菌(E. rectale)、罗氏弧菌(R. intestinalis)等(图2),这些细菌被以往研究多次报道富集在健康对照组[5, 6]。
另一方面,年轻和老年CRC患者都富集一些细菌,如脆弱拟杆菌(B. fragilis),卵形拟杆菌(B. ovatus),多形拟杆菌(B. thetaiotaomicron)和不解糖卟啉单胞菌(P. asaccharolytic)。其中,脆弱拟杆菌和不解糖卟啉菌是已知的炎症反应激发菌,有致癌潜能[11, 12]。
此外,年轻和老年CRC也有各自不同的特征细菌。例如,年轻CRC的特征表现为Flavonifractor plautii(Fp)和普通拟杆菌(B. vulgatus)富集,而老年CRC的特征表现为具核梭杆菌(F. nucleatum)的富集。Fp分泌的酶能高效地将人A型血转换成O型血[13],但人们对这个细菌和CRC的关系还知之甚少。
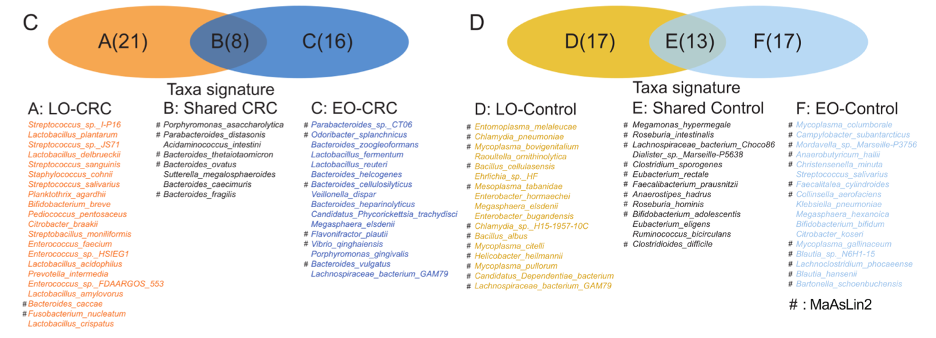
图2:癌症组和健康对照组中富集的细菌。LO-CRC:老年结直肠癌组;EO-CRC:年轻结直肠癌组;LO-Control:老年健康对照组;EO-CRC:年轻健康对照组。
粪便代谢谱分析发现,167个代谢物在年轻CRC和对照组中有显著差异(P<0.05),162个代谢物在老年CRC和健康对照中有显著差异(P<0.05)。
年轻和老年癌症组都发现了全氟辛基磺酸的富集,这是一种潜在的外毒素[14]。然而,年轻和老年CRC在代谢谱特征上有显著差异,具体表现为:年轻CRC富集氨酸、L-天冬氨酸、色氨酸及其衍生物、胆汁酸和胆碱;而老年CRC缺少精氨酸、乙酸和乙醛。
代谢谱特征很可能跟微生物的代谢活动有关联,因此研究者从宏基因组测序数据中分析微生物酶基因的组成,并聚焦于氨基酸和脂质代谢。
他们发现胆酸(初级胆汁酸)和脱氧胆酸(次级胆汁酸)合成酶基因cbh在年轻CRC中富集,这与代谢谱中发现胆汁酸在年轻癌症患者中富集互相验证。并且,胆酸和脱氧胆酸是已知的潜在致癌物质[15]。
在细菌-代谢物-酶基因的关联分析中,年轻CRC的特征表现为富集肉食相关普通拟杆菌,富集胆碱代谢物,以及缺少胆碱代谢相关酶基因pldB。老年CRC的特征表现为富集聚核梭杆菌和不解糖卟啉单胞菌,缺少乙酸和L-精氨酸,以及富集乙酸代谢酶atoA和atoD基因。
既然找到了CRC的特征,那么如果将这些标志物应用于癌症预测,可能会有很好的应用前景。为此,研究者基于细菌物种组成、代谢物水平和酶基因丰度,使用随机森林方法构建分类器,并且在一个独立队列中验证预测效果(24位年轻CRC和24位年轻对照;38位老年CRC和22位老年对照)。
在测试集中,细菌物种、代谢物和酶基因对老年CRC的预测效果较好,AUC(一种模型评价指标,值越大,评判效果越好)分别为78.17%、78.47和81.22%。当三种标志物组合在一起时,构建出来的模型预测效果最好,AUC可以达到82.36%(图3)。
在年轻CRC中,也是细菌物种-代谢物-酶基因三种标志物的联合预测效果最佳,AUC达到78.47%。在细菌物种、代谢物和酶基因分别构建分类器时,预测模型分别用到49个细菌物种、36个代谢物和59个酶基因。而在细菌物种-代谢物-酶基因的联合模型中,只用27个标志物就能达到比单一数据类型更好的效果。
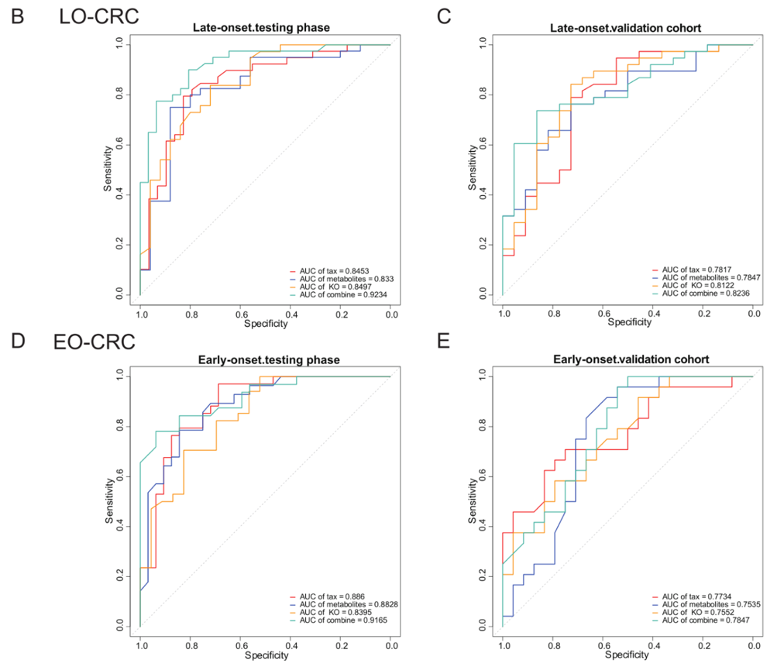
图3:基于粪便细菌-代谢物-酶基因标志物的对年轻和老年结直肠癌的预测效果。LO-CRC:老年结直肠癌组;EO-CRC:年轻结直肠癌组。
近年来,随着年轻人CRC患病率的升高,年轻肠癌患者的筛查成为CRC防控的新挑战。
马延磊团队的这项研究,基于粪便样品,从细菌物种、代谢物和酶基因三个层次挖掘年轻CRC的标志物,并且探索这些标志物在年轻CRC筛查中的前景,推动了基于粪便样品的CRC无创预测。不过,由于文章中的验证样本量小,模型的预测效果还需要在更大规模人群中验证。
综上所述,该项多组学研究在菌群谱和代谢谱上,揭示了年轻和老年CRC共有和特有的特征,为今后的CRC致病机制研究提供了基础。
参考文献
1.Wang, W., et al., Mortality and years of life lost of colorectal cancer in China, 2005-2020: findings from the national mortality surveillance system. Chinese medical journal, 2021. 134(16): p. 1933-1940.
2.Patel, S.G., et al., The rising tide of early-onset colorectal cancer: a comprehensive review of epidemiology, clinical features, biology, risk factors, prevention, and early detection. The Lancet Gastroenterology & Hepatology, 2022. 7(3): p. 262-274.
3.Eng, C., et al., A comprehensive framework for early-onset colorectal cancer research. The Lancet Oncology, 2022. 23(3): p. e116-e128.
4.Hofseth, L.J., et al., Early-onset colorectal cancer: initial clues and current views. Nature Reviews Gastroenterology & Hepatology, 2020. 17(6): p. 352-364.
5.Thomas, A.M., et al., Metagenomic analysis of colorectal cancer datasets identifies cross-cohort microbial diagnostic signatures and a link with choline degradation. Nature Medicine, 2019. 25(4): p. 667-678.
6.Wirbel, J., et al., Meta-analysis of fecal metagenomes reveals global microbial signatures that are specific for colorectal cancer. Nature Medicine, 2019. 25(4): p. 679-689.
7.Zhang, X., et al., Sex- and age-related trajectories of the adult human gut microbiota shared across populations of different ethnicities. Nature Aging, 2021. 1(1): p. 87-100.
8.Kong, C., et al., Integrated metagenomic and metabolomic analysis reveals distinct gut-microbiome-derived phenotypes in early-onset colorectal cancer. Gut, 2022.
9.Yang, Y., et al., Dysbiosis of human gut microbiome in young-onset colorectal cancer. Nature Communications, 2021. 12(1): p. 6757.
10.Krautkramer, K.A., J. Fan, and F. Bäckhed, Gut microbial metabolites as multi-kingdom intermediates. Nature Reviews Microbiology, 2021. 19(2): p. 77-94.
11.Cao, Y., et al., Enterotoxigenic Bacteroidesfragilis Promotes Intestinal Inflammation and Malignancy by Inhibiting Exosome-Packaged miR-149-3p. Gastroenterology, 2021. 161(5): p. 1552-1566.e12.
12.Wang, X., et al., Porphyromonas gingivalis Promotes Colorectal Carcinoma by Activating the Hematopoietic NLRP3 Inflammasome. Cancer Res, 2021. 81(10): p. 2745-2759.
13.Rahfeld, P., et al., An enzymatic pathway in the human gut microbiome that converts A to universal O type blood. Nat Microbiol, 2019. 4(9): p. 1475-1485.
14.Zhu, Y., et al., Perfluorooctane sulfonate promotes doxycycline-induced liver tumor progression in male Kras(v12) transgenic zebrafish. Environ Res, 2021. 196: p. 110962.
15.Song, X., et al., Microbial metabolite deoxycholic acid promotes vasculogenic mimicry formation in intestinal carcinogenesis. Cancer Sci, 2022. 113(2): p. 459-477.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


