覆盖HER2超低表达乳腺癌!Enhertu新适应症申报上市
来源:医药魔方 2024-08-20 13:16
目前,Enhertu是唯一一款获批用于治疗HER2低表达乳腺癌患者的疗法。HER2超低表达乳腺癌患者尚未有针对性疗法获批。
8月19日,第一三共与阿斯利康宣布Enhertu(德曲妥珠单抗)的新适应症上市申请获欧洲药品管理局(EMA)受理,用于单药治疗接受过至少一种内分泌疗法的不可切除或转移性HER2低表达(IHC 1+或2+/ISH-)或HER2超低表达(IHC 0)乳腺癌成人患者。

EMA此次受理主要是基于III期DESTINY-Breast06研究的积极结果。该研究是一项全球性、多中心、随机、开放标签、对照临床试验(n=866),评估了Enhertu(5.4mg/kg)与标准治疗(卡培他滨、紫杉醇、紫杉醇白蛋白)在接受内分泌治疗后疾病进展的HR阳性、HER2低表达或HER2超低表达转移性乳腺癌患者中的有效性与安全性。研究的主要终点是HR阳性、HER2低表达人群经盲法独立中央审查(BICR)评估的PFS,关键的次要终点包括HER2低表达患者的总生存期(OS)以及总人群的PFS和OS。
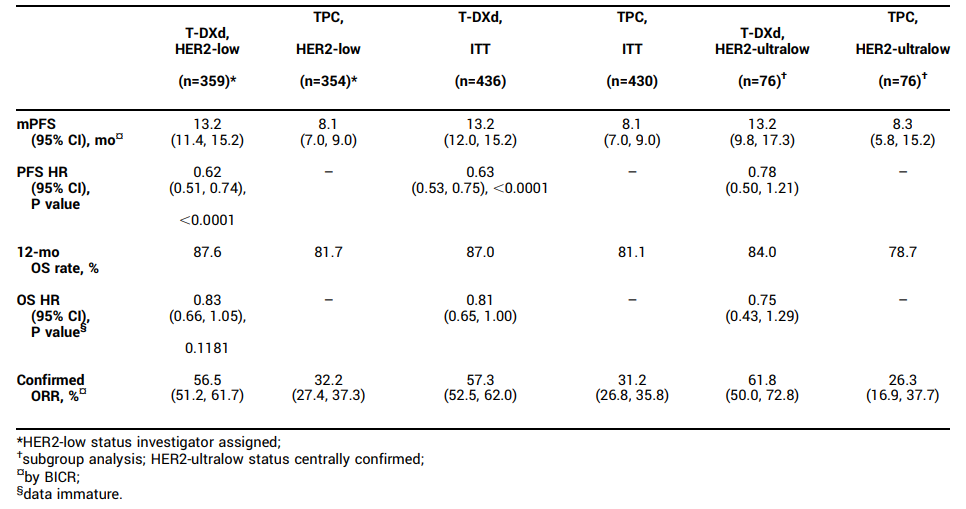
结果显示,在总人群中,Enhertu组患者的中位PFS相比标准治疗组显著延长(13.2 vs. 8.1个月,HR=0.63,P<0.0001),OS达到12个月的患者比例更高(87.0% vs. 81.1%,HR=0.81),确认的客观缓解率也更高(57.3% vs. 31.2%)。
HER2低表达人群亚组(n=713)的趋势与总人群一致。Enhertu组患者的中位PFS相比标准治疗组显著延长(13.2 vs. 8.1个月,HR=0.62,P<0.0001),OS达到12个月的患者比例更高(87.6% vs. 81.7%,HR=0.83),确认的客观缓解率也更高(56.5% vs. 32.2%)。
HER2超低表达人群亚组(n=153)的趋势同样与总人群一致。Enhertu组患者的中位PFS相比标准治疗组显著延长(13.2 vs. 8.3个月,HR=0.78),OS达到12个月的患者比例更高(84.0% vs. 78.7%,HR=0.75),确认的客观缓解率也更高(61.8% vs. 26.3%)。
据估计,HER2阳性(即HER2高表达)患者约占乳腺癌患者的15%-20%,而HR阳性/HER2阴性的乳腺癌患者中约有60%-65%呈HER2低表达,另有25%可能呈HER2超低表达。内分泌疗法被广泛应用于HR阳性转移性乳腺癌的早期治疗,但该疗法在接受过二线治疗的患者中的疗效往往有限。
目前,Enhertu是唯一一款获批用于治疗HER2低表达乳腺癌患者的疗法。HER2超低表达乳腺癌患者尚未有针对性疗法获批。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


