Nature Medicine:徐兵河院士团队发布Trop-2 ADC治疗HR+ HER2-转移性乳腺癌的3期临床数据
来源:生物世界 2024-10-09 11:51
这项临床试验达到了主要终点,与化疗相比,SG显著改善了亚洲的HR+HER2-mBC患者的无进展生存期和总生存期,且安全性可控,表明SG是亚洲HR+HER2-mBC患者的一种有前景的治疗选择。
乳腺癌(Breast Cancer,BC)是全世界女性中最常见的癌症,在中国女性中是第二大常见癌症(仅次于肺癌)。最常见的乳腺癌类型是激素受体阳性、人表皮生长因子受体2阴性乳腺癌(HR+HER2- BC),约占乳腺癌的70%。
目前对激素受体阳性、人表皮生长因子受体2阴性转移性乳腺癌(HR+HER2-mBC)的标准治疗是内分泌治疗联合CDK4/6抑制剂(CDK4/6i)作为一线治疗,一旦出现内分泌抵抗,则采用单一化疗药物作为后续治疗。而单药化疗的疗效有限且毒性较高,这凸显了HR+HER2-mBC患者对于额外治疗方案的迫切需求。
2024年10月1日,中国医学科学院北京协和医学院肿瘤医院徐兵河院士团队在 Nature Medicine 期刊发表了题为:Sacituzumab govitecan in HR+HER2- metastatic breast cancer: the randomized phase 3 EVER-132-002 trial 的临床试验论文。
这项亚洲患者参与的3期临床试验达到了主要终点,与化疗相比,戈沙妥珠单抗(Sacituzumab govitecan,SG)显著改善了亚洲HR+HER2-mBC患者的无进展生存期(PFS)和总生存期(OS),且安全性可控,表明了SG是亚洲HR+HER2-mBC患者的一种有前景的治疗选择。

戈沙妥珠单抗(Sacituzumab govitecan,SG)是一种Trop-2导向的抗体药物偶联物(Trop-2 ADC),其特异性靶向表达Trop-2的乳腺癌细胞,然后释放偶联的小分子毒素SN-38,以杀伤肿瘤细胞。目前,SG已在美国等多个国家获批用于治疗HR+HER2-转移性乳腺癌,还获批用于治疗三阴性转移性乳腺癌等。
在全球TROPiCS-02研究中,与化疗相比,戈沙妥珠单抗(Sacituzumab govitecan,SG)显著改善了激素受体阳性、人表皮生长因子受体2阴性转移性乳腺癌(HR+HER2-mBC)患者的无进展生存期(PFS)和总生存期(OS)。而TROPiCS-02研究纳入的亚洲患者很少。
在这项最新研究中,徐兵河院士团队报告了EVER-132-002研究结果,这是一项三期临床试验,旨在评估SG在亚洲HR+HER2- mBC患者中的治疗效果。患者随机分为SG组(166例)和化疗组(165例)。
在初步的无进展生存期(PFS)分析中(数据截止日期为2022年1月3日)中,相比化疗,SG显示出在主要终点PFS方面的统计学显著改善,疾病进展或死亡风险降低34%,SG治疗组的PFS中位时间为5.5个月,化疗组则为4.0个月。
在随后的预先指定的中期分析(数据截止日期为2022年7月1日)中,相比化疗,SG在总生存期(OS)方面显示出统计学上显著且具有临床意义的改善,SG治疗组的总生存期中位时间为14.4个月,化疗组则为11.2个月。SG治疗组的客观缓解率(ORR)和中位缓解持续时间(DoR)也高于化疗组,CG治疗组分别为21%和8.1个月,化疗组则分别为14%和5.6个月。
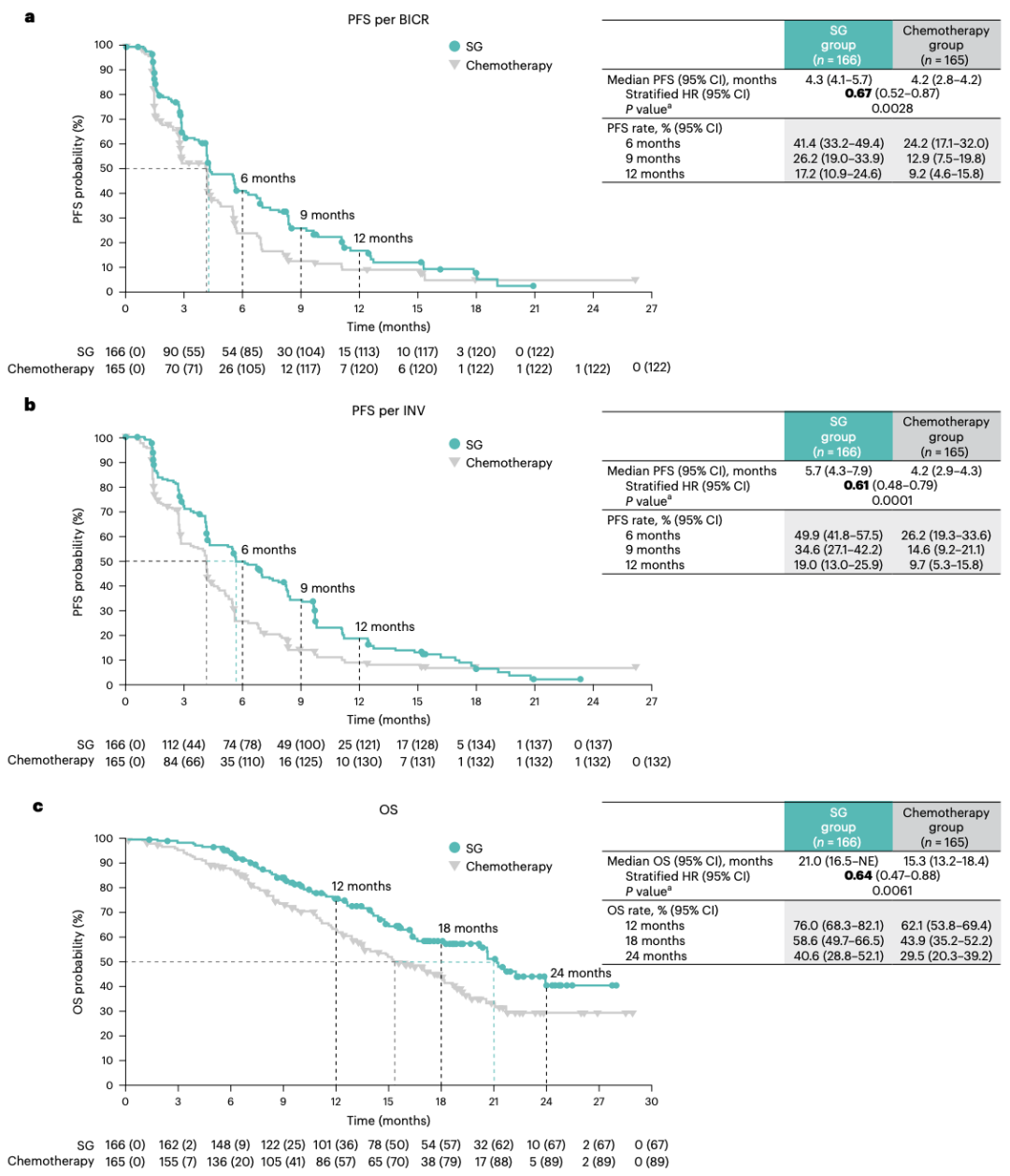
此外,SG安全性可控,与更早期的乳腺癌和其他肿瘤的临床试验结果相似。接受SG治疗的患者出现≥3级的治疗相关不良事件(TEAE)的比例高于接受化疗者(74% vs 60%),而导致治疗中断的TEAE发生率相似(6% vs 4%)。最常见的治疗相关不良事件包括中性粒细胞减少、白细胞减少和贫血。
总的来说,这项临床试验达到了主要终点,与化疗相比,SG显著改善了亚洲的HR+HER2-mBC患者的无进展生存期(PFS)和总生存期(OS),且安全性可控,表明SG是亚洲HR+HER2-mBC患者的一种有前景的治疗选择。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


