秦燕团队等开发新型光动力疗法,靶向肿瘤干细胞核糖体,实现肿瘤消融
来源:生物世界 2022-09-29 14:49
光动力治疗(Photodynamic therapy,PDT)是利用光敏剂和化疗药物组装成为纳米药物,靶向到肿瘤组织、利用光照作为药物释放和发挥功效的开关的一类治疗方案。
核糖体在每个哺乳动物中的拷贝数为千万,约占细胞中蛋白质总拷贝数的10%,RNA总量的85%,消耗细胞总ATP的50%以上,是细胞的物质和能量的占有者及蛋白质的合成者。
在快速增殖的细胞中,核糖体占有的物质、能量比例更高,是肿瘤干细胞(Caner stem cell,CSC)的重要标记物之一,且和许多CSC的表面标记物(如CD133, CD44等)有显著的相关性。
靶向核糖体的药物,对人类寿命的延长做出了最大的贡献,以1940年代开始大规模使用的抗生素为例,至今核糖体靶点的广谱抗生素是 FDA 等国际药监组织批准的最多种类的抗菌药物,特别是大环内酯类(Macrolides, 如14元环的红霉素及其衍生物,15元环的阿奇霉素,16元环的乙酰螺旋霉素)、氨基糖苷类(aminoglycoside,如庆大霉素,卡那霉素,链霉素等)和四环素,都是靶向核糖体的药物,为人类抗病菌、抗感染做出了巨大贡献。从广谱抗生素的临床使用以来,人类的平均寿命增加了一倍多,从30多岁到现在全球的70多岁。
光动力治疗(Photodynamic therapy,PDT)是利用光敏剂和化疗药物组装成为纳米药物,靶向到肿瘤组织、利用光照作为药物释放和发挥功效的开关的一类治疗方案。
近日,中国科学院生物物理研究所秦燕课题组和北京科技大学王天宇、姜建壮教授团队合作,在 Biomaterials 期刊发表了题为:Amino porphyrin-peptide assemblies induce ribosome damage and cancer stem cell inhibition for an enhanced photodynamic therapy 的研究论文。
该研究首次探索了将肿瘤干细胞(CSC)的核糖体作为靶向目标,新合成光动力药物,获得了肿瘤消融的良好抗瘤效果,并深入探索了抗瘤的分子机制。

研究团队首先合成了靶向核糖体的小肽和光敏剂的纳米材料,在远红外光的照射下,获得了良好的体外抑癌效果,特别是肿瘤干细胞的显著降低和核糖体的大量失活。小鼠实验(常规鼠和免疫缺陷鼠)得到了肿瘤消融的良好抗瘤效果,这主要由于PDT的疗效,其根本原因是肿瘤干细胞的核糖体严重受损。
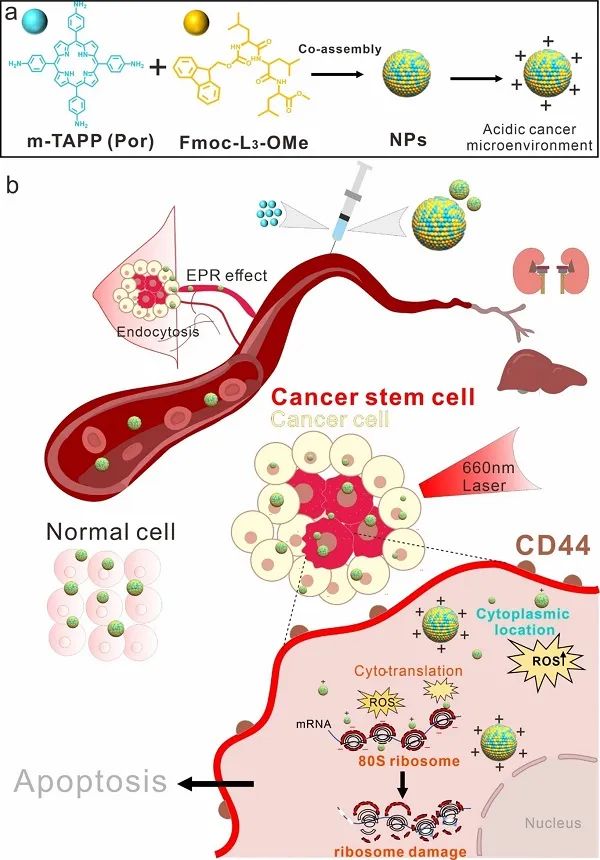
光动力药物抗肿瘤干细胞和核糖体抑制模型
中科院生物物理所秦燕研究员、北京科技大学王天宇和姜建壮教授、生物物理所丁芳助理研究员为本文的共同通讯作者。秦燕课题组实验师王健为本文第一作者,北京科技大学博士研究生杨包产为本文并列第一作者。生物物理所实验师吕超凡、郝俊峰、博士生孙雷等也参与了该项研究。该研究获得国家重点研发计划、国家自然科学基金资助。生物物理所实验动物平台为该研究提供了重要的技术支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


