Nature:我国科学家揭示组蛋白变体H2A.Z调节DNA复制起点机制
来源:本站原创 2020-01-04 21:05
2020年1月4日讯/生物谷BIOON/---DNA复制是一种受到严格控制的过程,这可确保在细胞增殖过程中基因组的精确复制。复制起点(replication origin)决定了基因组复制的起始位置,并调节了整个基因组复制程序。人类基因组包含成千上万个的复制起点。但是,每个细胞周期仅使用其中的10%。那么如何选择复制起点呢?在一项新的研究中,中国科学院生物物
2020年1月4日讯/生物谷BIOON/---DNA复制是一种受到严格控制的过程,这可确保在细胞增殖过程中基因组的精确复制。复制起点(replication origin)决定了基因组复制的起始位置,并调节了整个基因组复制程序。人类基因组包含成千上万个的复制起点。但是,每个细胞周期仅使用其中的10%。那么如何选择复制起点呢?
在一项新的研究中,中国科学院生物物理研究所的李国红(LI Guohong)课题组和朱明昭(ZHU Mingzhao)课题组证实组蛋白变体H2A.Z促进早期DNA复制起点的选择和激活。相关研究结果近期发表在Nature期刊上,论文标题为“H2A.Z facilitates licensing and activation of early replication origins”。
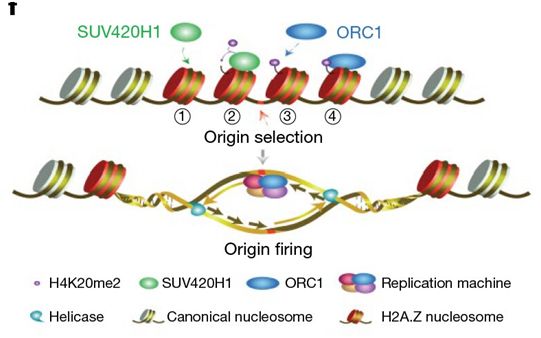
在真核生物中,DNA包裹在组蛋白八聚体周围,从而在细胞核中形成染色质。复制起点的选择和激活受到DNA序列和染色质特征的调节。但是,基于染色质的调节机制仍然在很大程度上是未知的。
在这项新的研究中,这些研究人员首先发现敲降HeLa细胞中的H2AFZ基因(即降低细胞中的H2AFZ基因表达)会导致细胞生长缺陷。通过质谱分析,复制前体复合物(prereplication complex)的许多亚基富集在H2A.Z单核小体(mono-nucleosome)上,这就表明H2A.Z可能参与了DNA复制起点的选择。
为了发现H2A.Z与复制前体复合物之间的相互作用机理,这些研究人员随后进行了体外生化分析,发现含H2A.Z的核小体直接与组蛋白赖氨酸甲基转移酶SUV420H1结合。这一过程促进了H4K20me2的沉积,进而招募复制起始识别复合物1(ORC1)以帮助完成DNA复制起点的选择。
此外,通过在HeLa细胞中进行全基因组研究,这些研究人员证实了H2A.Z在DNA复制中的作用。结果表明,来自H4K20me2、ORC1和新生DNA链的信号(指示有活性的DNA复制起点)与H2A.Z共定位,并且剔除H2A.Z会导致H4K20me2、ORC1和新生DNA链信号减少。与其他的复制起点相比,受到H2A.Z调控的复制起点具有更高的激活效率和更早的复制时间。
再者,这些研究人员还培育出CD4CreH2A.Zf/f小鼠,以便在生理环境下研究H2A.Z调控的复制功能。通过使用这些小鼠,他们有条件地敲除T细胞中的H2az1/H2az2。他们随后发现在这些小鼠中,活化的T细胞在细胞增殖和DNA复制方面存在缺陷。
这项新的研究描述了一种用于DNA复制起点选择的新型表观遗传调控机制,并提供了一种了解真核生物DNA复制调控的新方法。重要的是,这种调节途径可以潜在地成为癌症治疗靶点和用于调节免疫治疗期间的T细胞功能。(生物谷 Bioon.com)
参考资料:
1.Haizhen Long et al. H2A.Z facilitates licensing and activation of early replication origins. Nature, 2019, doi:10.1038/s41586-019-1877-9.
2.Scientists reveal function of histone variant H2A.Z in DNA replication selection
https://phys.org/news/2019-12-scientists-reveal-function-histone-variant.html
在一项新的研究中,中国科学院生物物理研究所的李国红(LI Guohong)课题组和朱明昭(ZHU Mingzhao)课题组证实组蛋白变体H2A.Z促进早期DNA复制起点的选择和激活。相关研究结果近期发表在Nature期刊上,论文标题为“H2A.Z facilitates licensing and activation of early replication origins”。

H2A.Z核小体直接结合Suv420H1,使得H4K20me2沉积在染色体上,这接着会招募ORC1到复制起点上。H2A.Z-Suv420H1-H4K20me2-ORC1轴选择性地选择和激活早期的复制起点。图片来自Dr. LI Guohong's lab。
在真核生物中,DNA包裹在组蛋白八聚体周围,从而在细胞核中形成染色质。复制起点的选择和激活受到DNA序列和染色质特征的调节。但是,基于染色质的调节机制仍然在很大程度上是未知的。
在这项新的研究中,这些研究人员首先发现敲降HeLa细胞中的H2AFZ基因(即降低细胞中的H2AFZ基因表达)会导致细胞生长缺陷。通过质谱分析,复制前体复合物(prereplication complex)的许多亚基富集在H2A.Z单核小体(mono-nucleosome)上,这就表明H2A.Z可能参与了DNA复制起点的选择。
为了发现H2A.Z与复制前体复合物之间的相互作用机理,这些研究人员随后进行了体外生化分析,发现含H2A.Z的核小体直接与组蛋白赖氨酸甲基转移酶SUV420H1结合。这一过程促进了H4K20me2的沉积,进而招募复制起始识别复合物1(ORC1)以帮助完成DNA复制起点的选择。
此外,通过在HeLa细胞中进行全基因组研究,这些研究人员证实了H2A.Z在DNA复制中的作用。结果表明,来自H4K20me2、ORC1和新生DNA链的信号(指示有活性的DNA复制起点)与H2A.Z共定位,并且剔除H2A.Z会导致H4K20me2、ORC1和新生DNA链信号减少。与其他的复制起点相比,受到H2A.Z调控的复制起点具有更高的激活效率和更早的复制时间。
再者,这些研究人员还培育出CD4CreH2A.Zf/f小鼠,以便在生理环境下研究H2A.Z调控的复制功能。通过使用这些小鼠,他们有条件地敲除T细胞中的H2az1/H2az2。他们随后发现在这些小鼠中,活化的T细胞在细胞增殖和DNA复制方面存在缺陷。
这项新的研究描述了一种用于DNA复制起点选择的新型表观遗传调控机制,并提供了一种了解真核生物DNA复制调控的新方法。重要的是,这种调节途径可以潜在地成为癌症治疗靶点和用于调节免疫治疗期间的T细胞功能。(生物谷 Bioon.com)
参考资料:
1.Haizhen Long et al. H2A.Z facilitates licensing and activation of early replication origins. Nature, 2019, doi:10.1038/s41586-019-1877-9.
2.Scientists reveal function of histone variant H2A.Z in DNA replication selection
https://phys.org/news/2019-12-scientists-reveal-function-histone-variant.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


