JAMA子刊:发现评估阿尔茨海默病药物疗效的血液标志物!
来源:奇点糕 2022-11-11 15:16
本研究发现了血浆pTau217和GFAP水平在Donanemab治疗显著降低,且与PET成像中显示出的大脑AD病理变化相一致。在今后的临床试验中,或可考虑将两者作为监测药物治疗效果的指标。
Donanemab为靶向β淀粉样蛋白(Aβ)N3pG的单抗药物,是为数不多的在临床试验中显示出对阿尔茨海默病(AD)患者有潜在治疗作用的药物之一。
在2期临床试验TRAILBLAZER-ALZ研究中(NCT03367403),Donanemab治疗达到了主要终点,即相比于安慰剂治疗,AD患者在Donanemab治疗76周后的阿尔茨海默病综合评分量表(iADRS,得分越低表示认知功能受损越严重)评分下降明显更少(疾病进展减缓32%)[1]。该研究也促使Donanemab在2021年6月被FDA授予治疗AD突破性疗法认定。
在临床试验中,判断AD药物的治疗效果除了使用量表(存在一定主观性)外,比较客观的评价方法为通过示踪剂对Aβ斑块和Tau蛋白过度磷酸化所致神经原纤维缠结进行正电子发射型计算机断层显像(PET),但这一方法显然不是十分方便。若能有血浆生物标志物等易于获得的指标能准确可靠地反映AD患者病情程度,则可以很方便地在临床试验中监测药物的治疗效果。
近日,由Michael J. Pontecorvo领衔的研究团队,对TRAILBLAZER-ALZ研究中参与者的数据进行了二次分析,探索了在早期症状性AD患者中,Donanemab治疗后血浆生物标志物Aβ42/40(AD中下降[2])、pTau217(AD中升高[3])、胶质纤维酸性蛋白(GFAP,AD中升高[4])和神经丝轻链(NfL,AD中升高[5])的变化,以及这些标志物与AD病情进展的相关性[6]。
研究表明,在接受Donanemab治疗后,相比于安慰剂治疗,AD患者血浆pTau217和GFAP显著降低。同时,血浆pTau217和GFAP变化还与Donanemab治疗后Aβ PET成像显示的大脑淀粉样斑块变化呈显著正相关,且血浆pTau217变化与Donanemab治疗后Tau PET成像显示的额叶与颞叶Tau标准化摄取值比率的变化呈显著正相关。
这些易于获得的血浆生物标志物今后可能成为AD药物治疗效果评估的一种简便方式,相关研究成果发表在著名期刊JAMA Neurology上。

论文首页截图
TRAILBLAZER-ALZ是一项随机对照的2期临床试验,于2017年12月18日至2020年12月4日在美国和加拿大的56个医疗中心进行,纳入研究的患者为记忆功能逐渐和进行性变化至少6个月的早期症状性AD患者。
这些参与者的简易精神状态检查分数为20-28,且Aβ和Tau PET成像显示脑内具有增多的淀粉样斑块及中等程度增多的沉积的Tau蛋白(由于靶向Aβ的药物在晚期AD患者[Tau蛋白明显升高]中效果不佳,因此本试验排除了Tau蛋白明显升高的AD患者)。
所有受试者被随机分配到Donanemab组(前3次Donanemab治疗剂量700mg,随后增加到1400mg,并视淀粉样斑块减少情况减量)或安慰剂组,每4周接受一次治疗,持续72周。
最终共有245名受试者纳入本研究,平均年龄75.2岁,女性占比53.3%(145人),其中Donanemab组125人,安慰剂组120人。
在基线时,AD患者血浆pTau217水平与Aβ和Tau PET成像显示的大脑淀粉样斑块(P=0.02)和Tau蛋白沉积(P<0.001)呈明显正相关,而血浆Aβ42/40、GFAP和NfL水平则和两者无明显相关性。
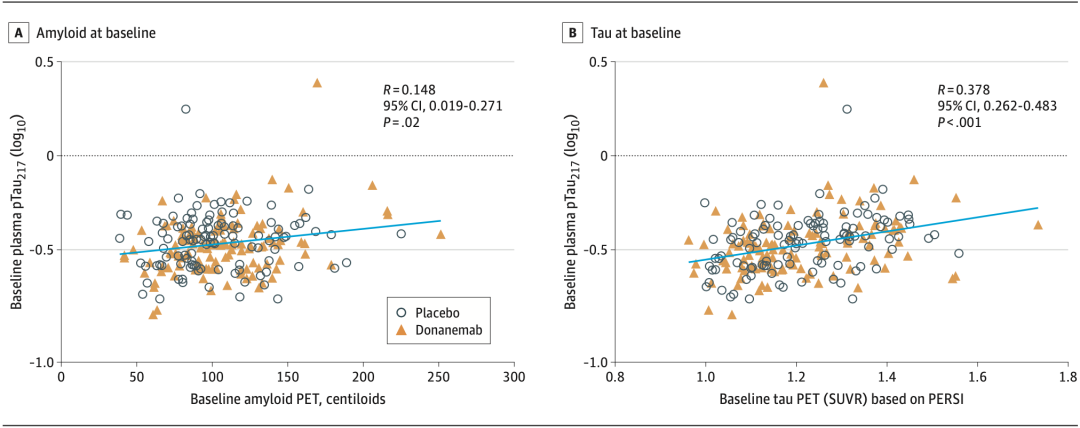
在基线时,AD患者血浆pTau217水平与Aβ和Tau PET成像显示的大脑淀粉样斑块和Tau蛋白沉积呈明显正相关
紧接着,研究人员分析了Donanemab治疗后AD患者血浆生物标志物的变化情况。
在治疗12周后,与安慰剂组相比,Donanemab组AD患者血浆pTau217水平就显著降低,并持续到研究的第76周。在完成所有Donanemab治疗后,AD患者平均血浆pTau217水平较基线下降23%。相比之下,安慰剂组AD患者平均血浆pTau217水平则上升了6%。
对于血浆GFAP水平,相比于安慰剂,其在Donanemab治疗12周后同样显著降低,并持续到第76周。在完成所有Donanemab治疗后,AD患者平均血浆GFAP水平较基线下降12%,而安慰剂组AD患者则上升了15%。
另外两个血浆生物标志物Aβ42/40和NfL水平,则在治疗完成后两组间无明显差异。在第76周时,Donanemab组平均Aβ42/40水平较治疗前增加了4%,而安慰剂组则增加了2%;Donanemab组平均血浆NfL水平比基线上升了15%,而安慰剂组则上升了19%。
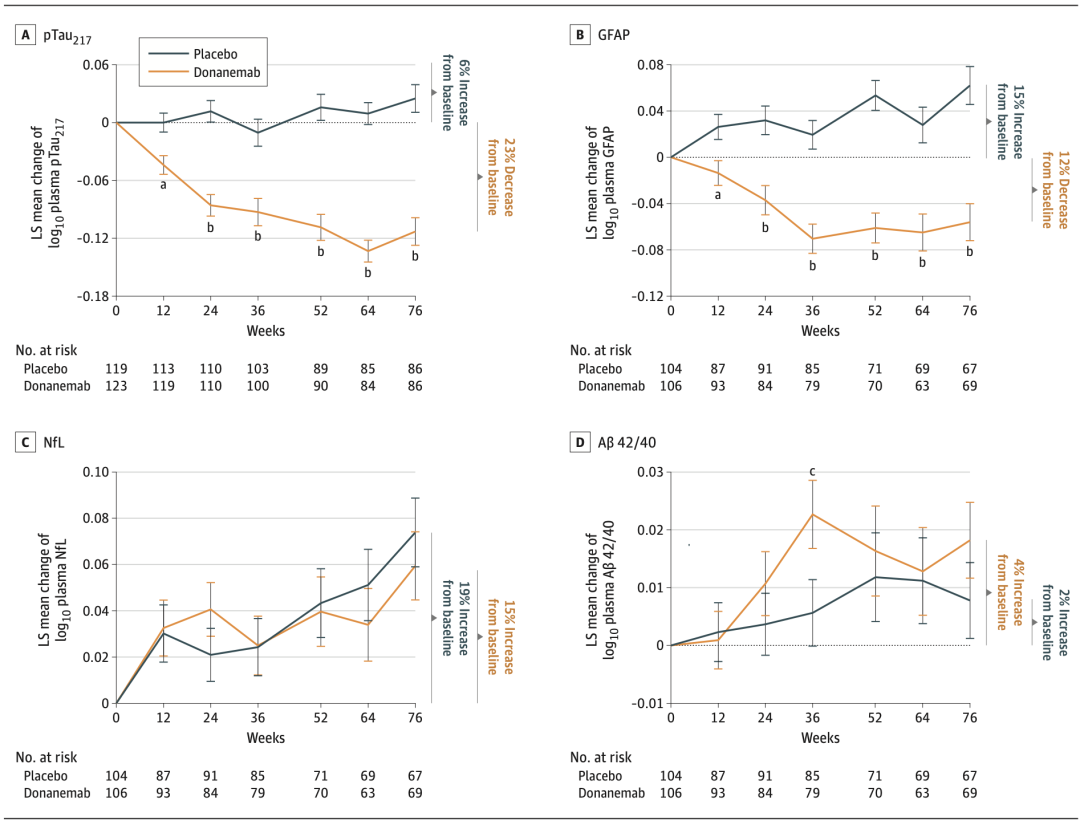
在试验期间血浆pTau217水平、GFAP水平、NfL水平、Aβ42/40水平变化
随后,研究人员分析了血浆生物标记物水平变化与Aβ和Tau PET成像结果的相关性。
结果显示,血浆pTau217(P<0.001)和GFAP(P<0.001)水平的变化与Aβ PET中观察到的淀粉样斑块变化呈正相关,且血浆pTau217的变化与额叶(P=0.02)和颞叶(P=0.02)Tau标准化摄取值比率的变化呈显著正相关。
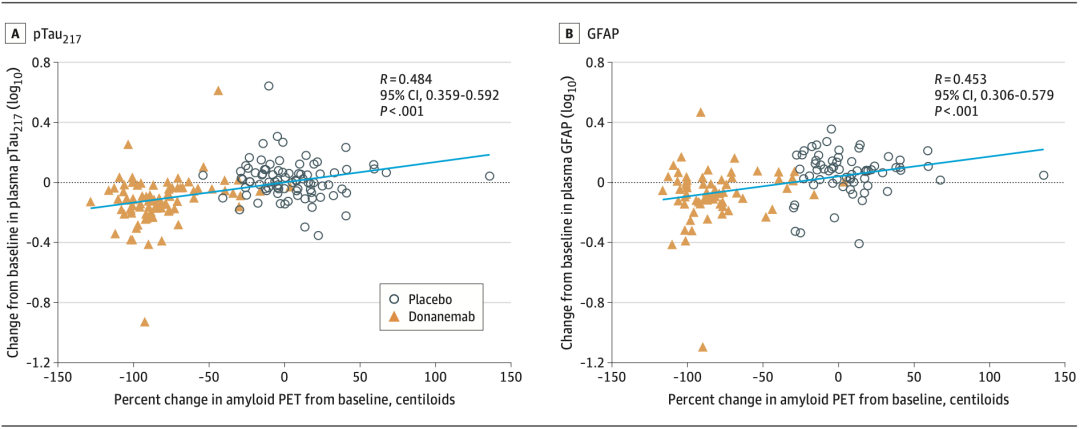
血浆pTau217和GFAP水平的变化与Aβ PET中观察到的淀粉样斑块变化呈正相关
而血浆pTau217和GFAP水平在基线时就呈显著正相关(P<0.001),并持续到研究结束的第76周(P<0.001),血浆pTau217和GFAP水平治疗前后的变化同样显著相关(P<0.001)。
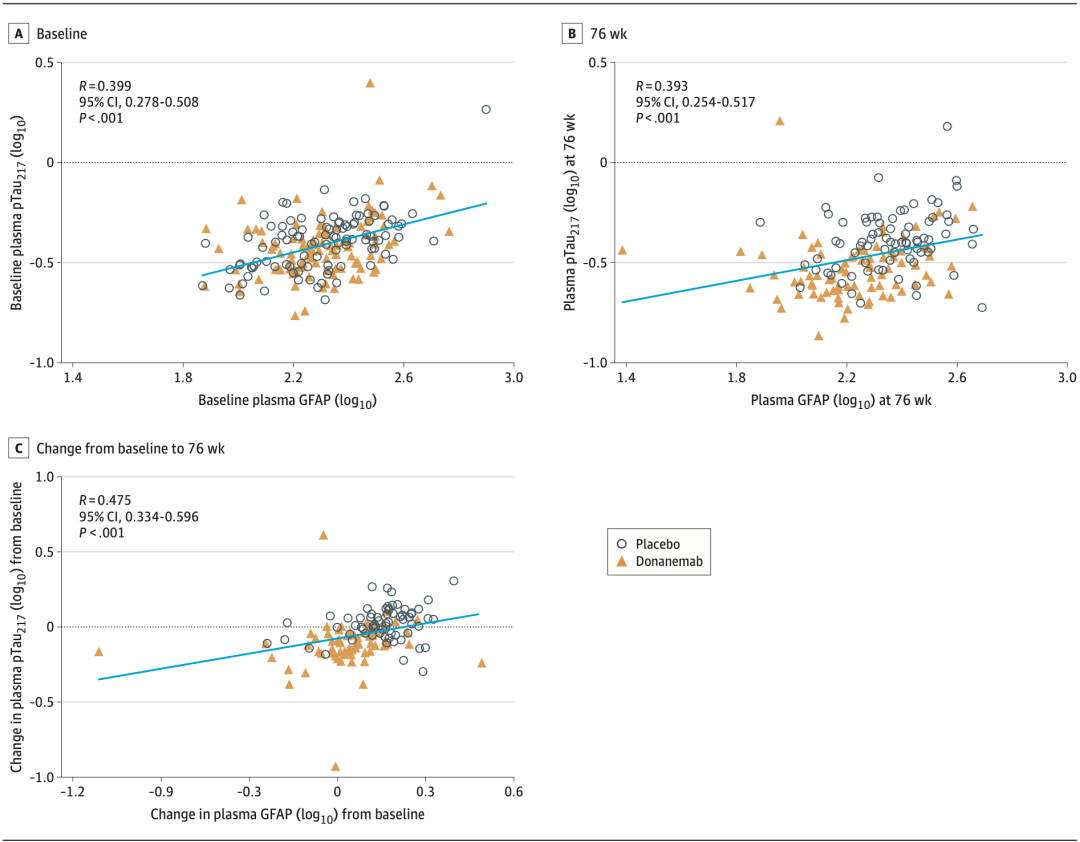
血浆pTau217和GFAP水平在基线和第76周水平以及治疗前后变化均呈明显正相关
这表明血浆pTau217和GFAP能一定程度反映大脑中AD病理程度。
紧接着,研究人员还分析了血浆生物标志物与MRI中全脑、脑室和海马体积的关系。在基线时,血浆pTau217、GFAP、NfL和Aβ42/40与上述脑体积指标无显著相关性。而在接受治疗后,仅有血浆NfL水平的变化与全脑体积的变化有显著相关性(P=0.03)。
最后,研究人员分析了血浆生物标志物与iADRS评分的关系。在基线时,血浆pTau217、GFAP、NfL和Aβ42/40水平与iADRs评分无显著相关性。在完成治疗后,仅GFAP的变化与iADRS评分的变化有显著相关性(P=0.02)。
然而,在将受试者根据iADRS评分的最小临床重要差异(MCID,区分受试者病情变化的最小分值变化)评估是否有病情恶化后,研究人员发现,在治疗24周时,血浆pTau217的变化与iADRS评分达到MCID的几率呈正相关(P=0.04)。也就是说,血浆pTau217水平下降,则iADR评分出现病情恶化的概率越低。
总的来说,本研究发现了血浆pTau217和GFAP水平在Donanemab治疗显著降低,且与PET成像中显示出的大脑AD病理变化相一致。在今后的临床试验中,或可考虑将两者作为监测药物治疗效果的指标。
参考文献
1.Mintun MA, Lo AC, Duggan Evans C, Wessels AM, Ardayfio PA, Andersen SW, Shcherbinin S, Sparks J, Sims JR, Brys M et al: Donanemab in Early Alzheimer's Disease. N Engl J Med 2021, 384(18):1691-1704.
2.Palmqvist S, Janelidze S, Stomrud E, Zetterberg H, Karl J, Zink K, Bittner T, Mattsson N, Eichenlaub U, Blennow K et al: Performance of Fully Automated Plasma Assays as Screening Tests for Alzheimer Disease-Related beta-Amyloid Status. JAMA Neurol 2019, 76(9):1060-1069.
3.Janelidze S, Berron D, Smith R, Strandberg O, Proctor NK, Dage JL, Stomrud E, Palmqvist S, Mattsson-Carlgren N, Hansson O: Associations of Plasma Phospho-Tau217 Levels With Tau Positron Emission Tomography in Early Alzheimer Disease. JAMA Neurol 2021, 78(2):149-156.
4.Pereira JB, Janelidze S, Smith R, Mattsson-Carlgren N, Palmqvist S, Teunissen CE, Zetterberg H, Stomrud E, Ashton NJ, Blennow K et al: Plasma GFAP is an early marker of amyloid-beta but not tau pathology in Alzheimer's disease. Brain 2021, 144(11):3505-3516.
5.Mattsson N, Andreasson U, Zetterberg H, Blennow K, Alzheimer's Disease Neuroimaging I: Association of Plasma Neurofilament Light With Neurodegeneration in Patients With Alzheimer Disease. JAMA Neurol 2017, 74(5):557-566.
6. Pontecorvo MJ, Lu M, Burnham SC, Schade AE, Dage JL, Shcherbinin S, Collins EC, Sims JR, Mintun MA: Association of Donanemab Treatment With Exploratory Plasma Biomarkers in Early Symptomatic Alzheimer Disease: A Secondary Analysis of the TRAILBLAZER-ALZ Randomized Clinical Trial. JAMA Neurol 2022.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


