《细胞研究》:科学家首次证实,阿司匹林能促进DNA双链断裂高保真修复
来源:奇点糕 2023-03-22 10:36
事实确实如此,阿司匹林处理导致Ac-H4K16水平升高,促进同源重组修复蛋白BRCA1在断裂处聚集。
德国弗莱堡大学医学中心Nelson O Gekara团队在著名期刊Cell Research上发了一篇论文,说是阿司匹林可以让细胞免遭基因毒性[1]。
原来他们发现,在DNA受到损伤发生双链断裂之后,阿司匹林可以促进断裂部位染色质打开,以及招募同源重组修复蛋白BRCA1聚集在断裂处,促进断裂DNA的高保真修复,避免DNA损伤对细胞的不良影响。
Gekara等认为,这一新发现的机制或许能解释阿司匹林对健康的诸多益处,包括预防癌症。去年入职哈尔滨工业大学生命科学与技术学院的蒋晖副教授是论文的第一作者。

论文首页截图
阿司匹林(乙酰水杨酸)是人类历史上最古老的药物之一,据说在4000多年前就有含阿司匹林的药物被用于治疗疼痛、炎症和发烧了。
近年来,很多研究表明,阿司匹林可以预防心血管疾病[2],甚至对某些癌症也有一定的预防效果[3]。阿司匹林的抗炎功能被认为是疗效的关键。
Gekara团队想知道阿司匹林的抗炎功能,是不是可以降低辐射对身体的伤害,因为炎症是辐射引起组织损伤的关键驱动因素[4]。
基于小鼠模型,他们发现阿司匹林确实可以防止辐射导致的骨髓消融,并抑制多种炎症相关基因的表达。从这个结果来看,阿司匹林的骨髓保护作用确实与抗炎作用有关。
Gekara和他的同事也没想到,他们看到的其实只是表象。
当他们将几个模式识别受体(PRRs)驱动的炎症信号通路都阻断之后,阿司匹林竟然对骨髓还有保护作用,也能抑制炎症相关基因的表达。
如此看来,阿司匹林对骨髓的保护作用是独立于PRRs驱动的炎症,这说明背后还隐藏有其他原因。
想来想去,Gekara和他的同事决定从DNA的双链断裂入手,因为辐射对细胞最大的直接伤害就是导致DNA双链断裂。
为了研究阿司匹林对DNA双链断裂的影响,他们选择了HEK293细胞系作为研究对象,这个细胞系PRRs通路缺陷,阿司匹林的主要靶点(COX1和COX2)也缺陷。这就有效地排除了抗炎作用的干扰。
研究结果让他们欣喜,阿司匹林确实可以减少DNA的双链断裂。哪怕先用辐射诱发DNA双链断裂,再用阿司匹林处理仍能促进DNA双链断裂的修复。此外,阿司匹林也能加速由抗癌药物多柔比星诱导的DNA双链断裂的修复。
那阿司匹林究竟是如何实现这一技能的呢?以及DNA双链断裂主要通过高保真的同源重组(HR)和低保真的非同源末端连接(NHEJ)完成修复,阿司匹林又影响了哪一个呢?
通过大量的实验,Gekara团队发现,阿司匹林可能是直接乙酰化了组蛋白H4上的一个赖氨酸(Ac-H4K16)。这种乙酰化会减少核小体的堆叠和染色质的折叠,简单来说就是让断裂点暴露出来,促进修复蛋白聚集在断裂位点。
事实确实如此,阿司匹林处理导致Ac-H4K16水平升高,促进同源重组修复蛋白BRCA1在断裂处聚集。
基于小鼠模型的体内研究发现,辐射处理的小鼠接受阿司匹林治疗后体内Ac-H4K16升高,DNA损伤标志物γ-H2A水平下降,这说明DNA的损伤程度确实下降了。而且阿司匹林治疗的小鼠生存期延长,辐射症状较轻,这也表明对小鼠的健康有益。
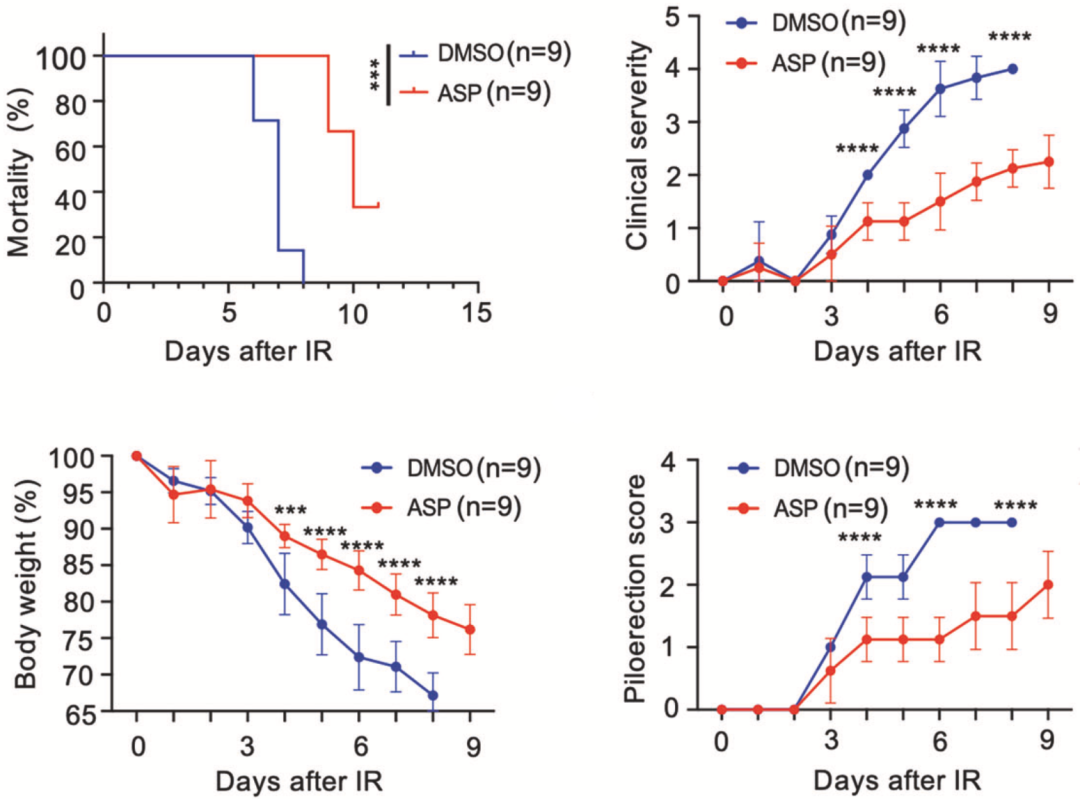
阿司匹林的治疗效果
总的来说,Gekara团队的这一研究表明,除了经典的抗炎作用之外,阿司匹林还是高保真同源重组修复的放大器,能对基因组的稳定起到保护作用。
他们也认为,这一新机制的发现,或许有助于解释阿司匹林的诸多好处,尤其是在预防癌症方面。
参考文献:
[1].Jiang H, Swacha P, Aung KM, Gekara NO. Aspirin protects against genotoxicity by promoting genome repair. Cell Res. 2023. doi:10.1038/s41422-023-00783-6
[2].Montinari MR, Minelli S, De Caterina R. The first 3500 years of aspirin history from its roots - A concise summary. Vascul Pharmacol. 2019;113:1-8. doi:10.1016/j.vph.2018.10.008
[3].Thun MJ, Jacobs EJ, Patrono C. The role of aspirin in cancer prevention. Nat Rev Clin Oncol. 2012;9(5):259-267. Published 2012 Apr 3. doi:10.1038/nrclinonc.2011.199
[4].Härtlova A, Erttmann SF, Raffi FA, et al. DNA damage primes the type I interferon system via the cytosolic DNA sensor STING to promote anti-microbial innate immunity. Immunity. 2015;42(2):332-343. doi:10.1016/j.immuni.2015.01.012
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


