《科学》:癌细胞是这样诞生的!科学家找到细胞成癌关键,三个因素共同决定细胞命运
来源:奇点糕 2021-10-30 12:22
经典理论认为,癌症是由于人体内DNA突变的不断累积造成的,只要激活原癌基因、失活抑癌基因,癌症就发生了。但是,同样的突变在不同的情况下可能会致癌,也可能不致癌。例如,构成痣的细胞就存在BRAF基因突变,该突变在某些情况下会导致黑色素瘤,但是绝大多数的痣永远也不会癌变。那么,这一现象背后的原因是什么呢?近日,由来自纪念斯隆-凯特琳癌症中
经典理论认为,癌症是由于人体内DNA突变的不断累积造成的,只要激活原癌基因、失活抑癌基因,癌症就发生了。
但是,同样的突变在不同的情况下可能会致癌,也可能不致癌。例如,构成痣的细胞就存在BRAF基因突变,该突变在某些情况下会导致黑色素瘤,但是绝大多数的痣永远也不会癌变。
那么,这一现象背后的原因是什么呢?
近日,由来自纪念斯隆-凯特琳癌症中心的Richard M. White博士和Lorenz Studer博士合作领衔的研究团队,在著名期刊《科学》上发表重要研究成果[1]。
他们研究发现“致癌能力”是由致癌基因(如BRAFV600E)、谱系特异性转录因子(如SOX10)和发育调节的染色质因子(如ATAD2)共同介导的。
在皮肤细胞中,神经嵴谱系特异性机制的激活和BRAFV600E等致癌突变是造成恶性肿瘤的基础条件[2-7]。那么,为什么神经嵴的状态特别容易受到BRAFV600E致癌突变的影响?
在发育过程中,神经嵴细胞产生黑色素母细胞,然后进一步分化为黑色素细胞。White博士利用斑马鱼模型,在抑癌基因p53突变的背景下,激活BRAFV600E来引发肿瘤的产生。BRAFV600E由三种阶段特异性启动子驱动,分别是sox10启动子(神经嵴细胞)、mitfa启动子(黑色素母细胞)和tyrp1启动子(黑色素细胞)。
研究发现由tyrp1启动子控制的BRAFV600E并没有激发黑色素细胞中肿瘤的产生,只是形成了小块痣样的细胞。这表明致癌基因表达可以使神经嵴细胞和黑色素母细胞有“致癌能力”,而黑色素细胞没有。
通过对两种不同的肿瘤进行组织学和RNA测序分析,发现这两种肿瘤在组织学和转录水平都是不同的。神经嵴来源的肿瘤表达神经元基因,而黑色素母细胞来源的黑色素瘤表达与黑色素细胞谱系相近。
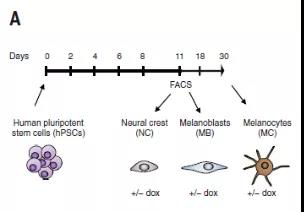
为了进一步做机制上的研究,White博士和Studer博士建立了人类多功能干细胞(hPSC)模型:在hPSC中抑制RB1、P53和P16这三个抑癌基因(3xKO细胞),再通过多西环素(dox)诱导致癌的BRAFV600E表达来激活肿瘤。3xKO工程化细胞随后分化为神经嵴细胞、黑色素母细胞和成熟的黑色素细胞。
在NSG小鼠通皮下注射分化后的3xKO,发现了与斑马鱼相似的结果:3xKO dox神经嵴细胞和黑色素母细胞都容易形成肿瘤,而3xKO dox黑色素细胞基本上没有。3xKO黑色素母细胞衍生肿瘤的所有黑色素瘤常见标志物均呈阳性,而两种RNA结合蛋白HuC和HuD呈阴性,并且在病理上被归类为促纤维增生性黑色素瘤。
White和Studer对三种不同的细胞进行RNA测序,将表达谱和癌症基因组图谱 (TCGA) 的数据对比,发现hPSC衍生的3xKO dox神经嵴细胞和3xKO dox黑色素细胞与人类黑色素瘤患者样本具有显着的相似性。这说明,研究人员通过hPSC衍生的肿瘤与人类患者有相关性。
通过对比WT和3xKO细胞在不同状态下的RNA测序结果,White发现dox诱导的 BRAFV600E表达在神经嵴细胞和黑色素母细胞中都有显着的转录变化。
WT黑色素母细胞和WT黑色素细胞中的基因集通路分析(GSAA)显示,与染色质修饰相关的多条通路在黑色素母细胞中富集,并且通过对两种细胞进行染色质相关基因差异分析,发现了特定染色质修饰因子在黑色素母细胞中的富集。这表明黑色素母细胞表达表观遗传相关因子,能够响应BRAFV600E改变其染色质状态。
为了分析具体是哪个染色质因子最重要,White对比了黑色素细胞与黑色素母细胞的不同,并分析了在TCGA人类黑色素瘤队列中哪些是表达量更高的,通过这些分析发现了3个相关因子:BPTF(溴基结构域PHD指转录因子)、ATAD2(ATP酶家族AAA结构域蛋白2)和 EZH2(zeste同源物2的组蛋白甲基转移酶增强子)。
ATAD2是一种腺苷三磷酸酶(ATPase)[8],已知在染色质可及性中发挥作用,并且与黑色素瘤的存活率呈负相关[9];与其余患者相比,表达较高的患者的存活率明显更差。
White利用病毒在3xKO细胞中诱导ATAD2表达,发现没有ATAD2的黑素细胞被黑色素深深着色,但表达ATAD2的3xKO黑色素细胞减少了色素沉着。
White接下来对3xKO dox黑色素母细胞、3xKO dox黑色素细胞和3xKO ATAD2 dox黑色素母细胞进行了高通量转座酶可及染色质测序(ATAC-seq),发现黑色素母细胞中过表达ATAD2可以增加神经嵴相关位点染色质可及性。
通过进一步的机制研究,White利用Homer基序分析发现ATAD2富集基序是SOX10,表明ATAD2特异地与SOX10结合。对携带SOX10基序的基因座进行网络分析,发现了神经嵴迁移相关通路的富集。
有研究表明,ATAD2能够与Myc构建蛋白复合物[10]。White假设ATAD2与SOX10可能以类似的方式发挥作用,通过直接与其结合并促进其靶基因的转录。
为了验证这一想法,White分析了TCGA队列中ATAD2高表达和ATAD2低表达患者的基因表达差异,发现ATAD2高表达患者的基因有明显的Myc特征且具有SOX基序富集。接下来White通过免疫共沉淀(co-IP)证实ATAD2与Myc形成复合物,并发现它也与SOX10形成复合物。
基于这些发现,White提出假设:ATAD2可能发挥双重作用并促进Myc和SOX10转录因子靶基因的表达。White对3xKO ATAD2 dox黑色素母细胞中的ATAD2、SOX10和Myc进行了CUT&RUN分析,发现ATAD2与SOX10和Myc结合,并通过RNA-seq分析发现神经嵴相关基因(MEIS2、CDH2 和 CDH11)显着富集。
为了研究ATAD2在体内环境下是否致癌,White在转基因斑马鱼中特异性表达和敲减ATAD2,发现在神经嵴细胞和黑色素母细胞中高水平ATAD2表达促使BRAFV600E激发肿瘤。
以上研究表明致癌能力似乎取决于三个相互关联的因素:DNA突变(例如BRAFV600E、p53-/-、CDKN2A-/-和PTEN-/-);细胞类型特异性转录因子(如SOX10和MITF);以及发育调控染色质修饰因子的固有水平。它们共同决定了癌症易感性。
这一研究刷新了人们对于致癌机制的认知,可以研究靶向抑制ATAD2的药物治疗黑色素瘤,为黑色素瘤的治疗提供了新的思路。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


