NSR:金帆团队开发近红外光编程细菌,用于实体瘤治疗
来源:生物世界 2023-04-11 15:05
通过合成生物学的设计,研究团队成功地将铜绿假单胞菌菌株改造成为具有实体瘤治疗功效的工程菌。在治疗过程中,该工程菌的全局表型可被近红外光的辐照程序精确的控制,即:在弱定殖、定殖以及裂解释药三种表型切换,
近年来,合成生物学的快速发展为肿瘤细菌疗法的深度优化带来新的契机。基于合成生物学手段,科学家们能够利用基因工程改造的微生物或细胞而非传统的化学小分子或生物制剂,作为新型疾病治疗方法的开发基础。人工设计的携带有合成基因线路的微生物或细胞能够响应疾病标志物或者外界信号,实现对药物释放位置、释放时间和释放剂量的控制,已逐渐发展为人类对抗疾病的强有力武器。
在传统的细菌改造基础上,经过理性设计的基因通路赋予了底盘细菌更多样化的治疗能力,弥补了天然菌株在肿瘤治疗方面的缺陷,肿瘤细菌疗法也因此成为极富应用前景的新型肿瘤疗法。现有肿瘤细菌疗法的优化策略主要集中在新型药物的应用、新型可控释放方式的引入等,但是却忽略了细菌自身行为对肿瘤治疗效果的影响,缺乏对肿瘤治疗过程中细菌行为的持续控制。肿瘤治疗是一个长期的过程,可控持续的药物释放是提高肿瘤治疗效果的关键,虽然在材料领域通过高分子水凝胶和脂质等已经实现了药物的持续释放,但是在肿瘤细菌疗法中仍然是一个挑战。
近日,中国科学院深圳先进技术研究院合成生物学研究所金帆课题组在 National Science Review 期刊发表了题为:Programming the lifestyles of engineered bacteria for cancer therapy 的研究成果。
通过合成生物学的设计,研究团队成功地将铜绿假单胞菌菌株改造成为具有实体瘤治疗功效的工程菌。在治疗过程中,该工程菌的全局表型可被近红外光的辐照程序精确的控制,即:在弱定殖、定殖以及裂解释药三种表型切换,从而更有效的消融瘤体达到治疗效果,具有巨大的潜在应用价值。
审稿人认为该工作具有极高的创新性且总体设计思路非常精妙,将对肿瘤细菌疗法领域产生巨大的影响(“The overall system design is highly elegant”,“I believe the work will have a major impact in the field”)。

在自然界中,铜绿假单胞菌在有利的环境中处于浮游状态,其在表面定殖的能力较弱;而在不利的环境中则会进入生物被膜状态,其表面定殖能力大大增强。受到自然界中细菌生存方式的启发,研究团队为工程菌设计了浮游状态和生物被膜状态以实现对其定殖能力的控制,其中浮游状态细菌的定殖能力较弱,能够减少对正常组织的伤害;而生物被膜状态细菌的定殖能力较强,能够增加其在肿瘤组织内的定殖量。
研究团队通过敲除毒力因子调控蛋白编码基因vfr和三型分泌系统相关基因exoS和exoT构建了减毒的铜绿假单胞菌菌株作为肿瘤细菌疗法中的新型底盘菌株。铜绿假单胞菌在浮游状态和生物被膜状态两种生活方式之间的切换与第二信使分子环二鸟苷酸(c-di-GMP)的浓度密切相关,为此,研究团队使用两个基因模块对细菌胞内的c-di-GMP浓度进行控制,分别是:
1)通过组成型启动子表达磷酸二酯酶PA2133以分解c-di-GMP,使细菌维持较低的胞内c-di-GMP水平,进入浮游状态;
2)引入可在近红外光照射下合成c-di-GMP的光敏蛋白BphS,近红外光照射可使细菌胞内c-di-GMP水平升高,细菌进入生物被膜状态。此外,为了实现治疗药物的控制释放,研究团队为工程菌设计了第三种生活方式,即裂解状态,通过c-di-GMP响应型启动子表达裂解基因,可使细菌在c-di-GMP升高后进入裂解状态(图1)。这样,细菌的三种生活方式便均与c-di-GMP的浓度相关。通过改变近红外光的照射强度,可以控制活化的BphS蛋白的数量,进而调节工程菌胞内的c-di-GMP的浓度,从而实现对细菌生活方式的控制。除了光照强度的影响,理论模拟的结果表明:PA2133上游的核糖体结合位点(RBS1)与抗终止蛋白Q上游的核糖体结合位点(RBS2)的强度将对使细菌进入不同的生活方式所需的近红外光光强产生巨大的影响。
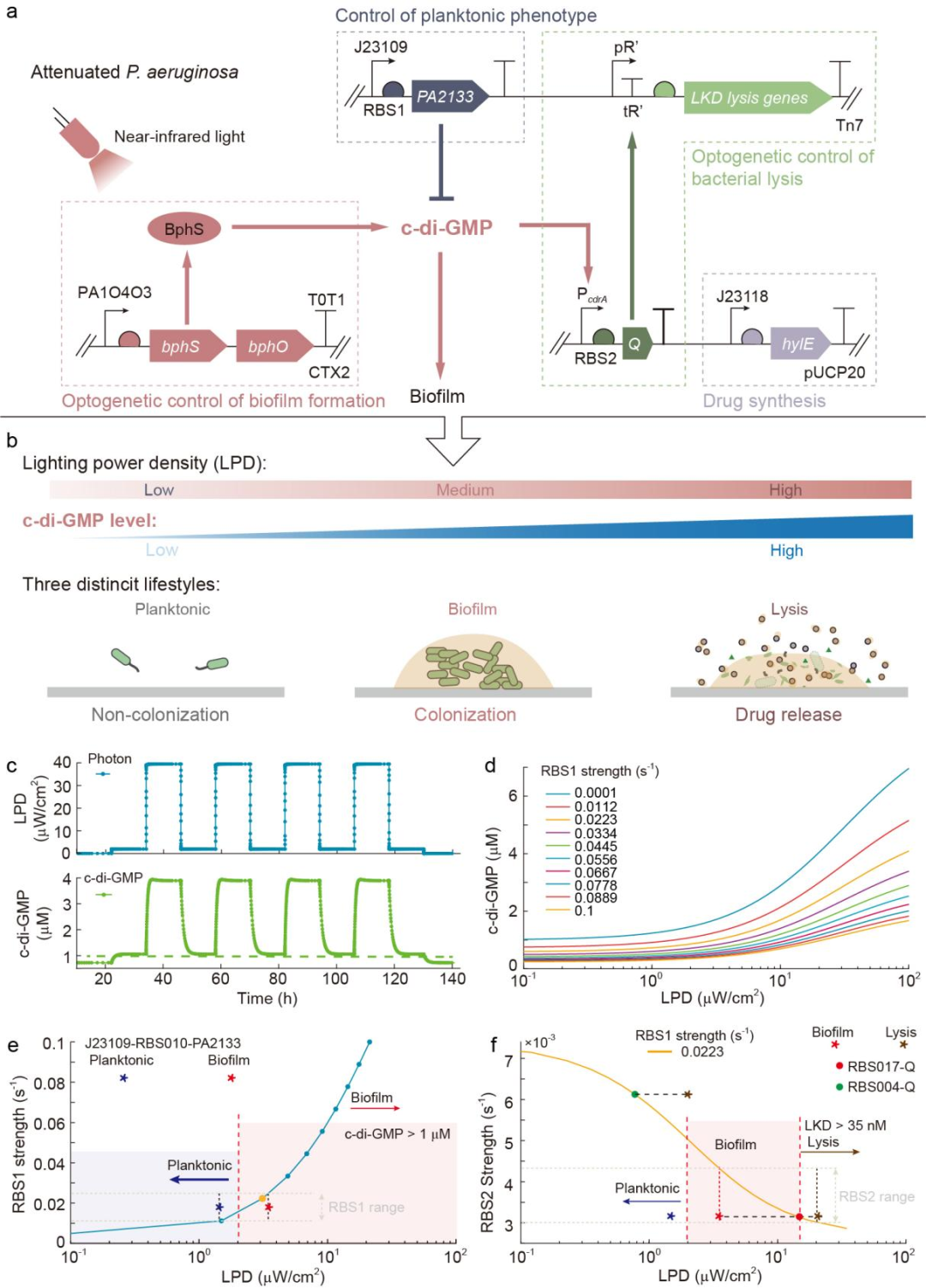 图1:用于编程细菌生活方式的基因线路的设计
图1:用于编程细菌生活方式的基因线路的设计
为了获得能够在不同强度的近红外光照射下呈现三种生活方式的工程菌,研究团队对RBS1和RBS2进行批量替换,并通过96孔光照装置对候选菌株进行批量筛选,随后利用显微镜进行验证,最终得到的工程化菌株被命名为H017(图2)。通过层级性调控近红外光的照射强度可以编程H017的生活方式,当对H017施加中等强度-高强度循环的近红外光光照程序时,细菌将进入生物被膜状态-裂解状态生活方式循环。
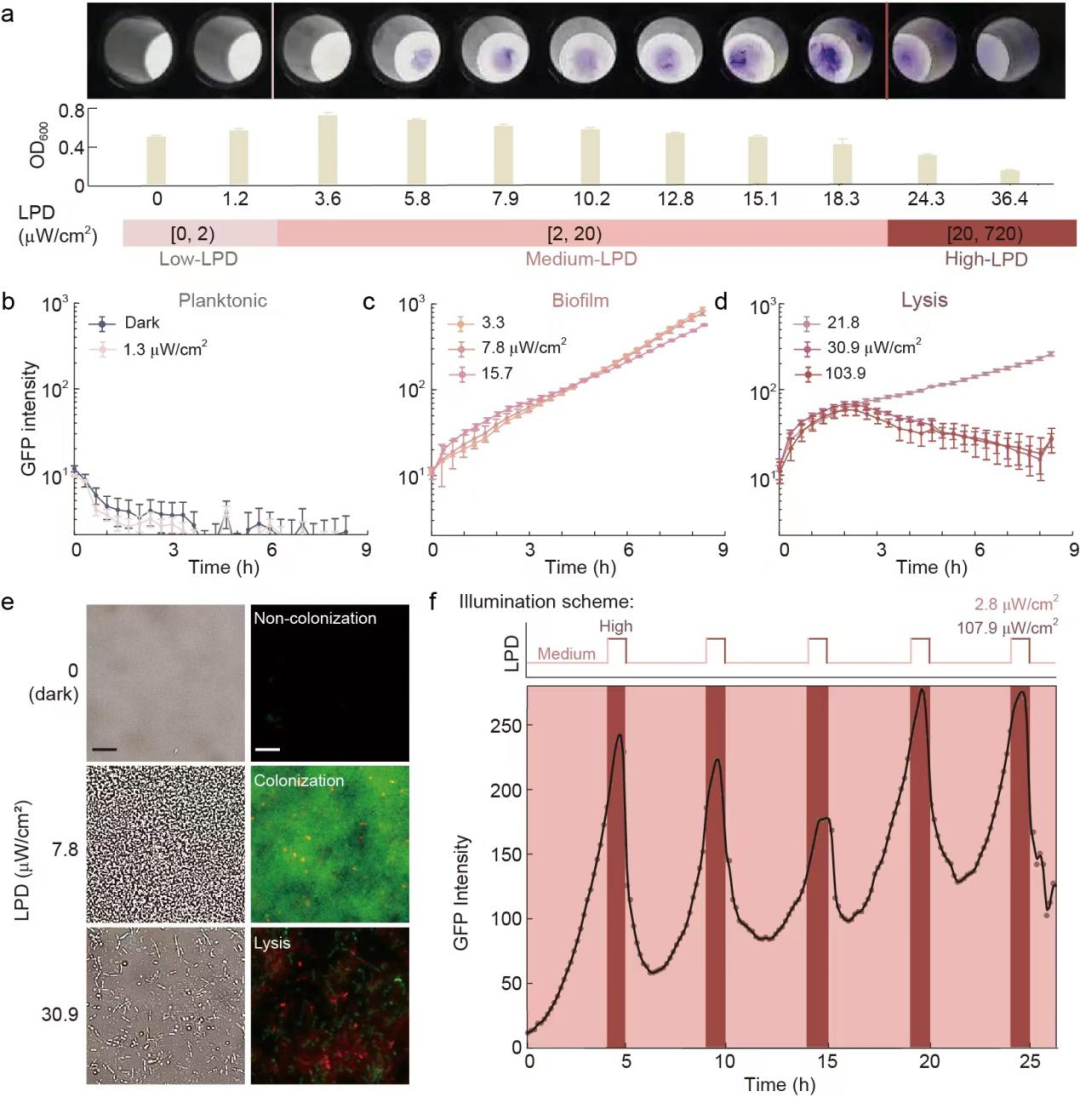
图2 通过层级性调节近红外光的强度编程细菌生活方式
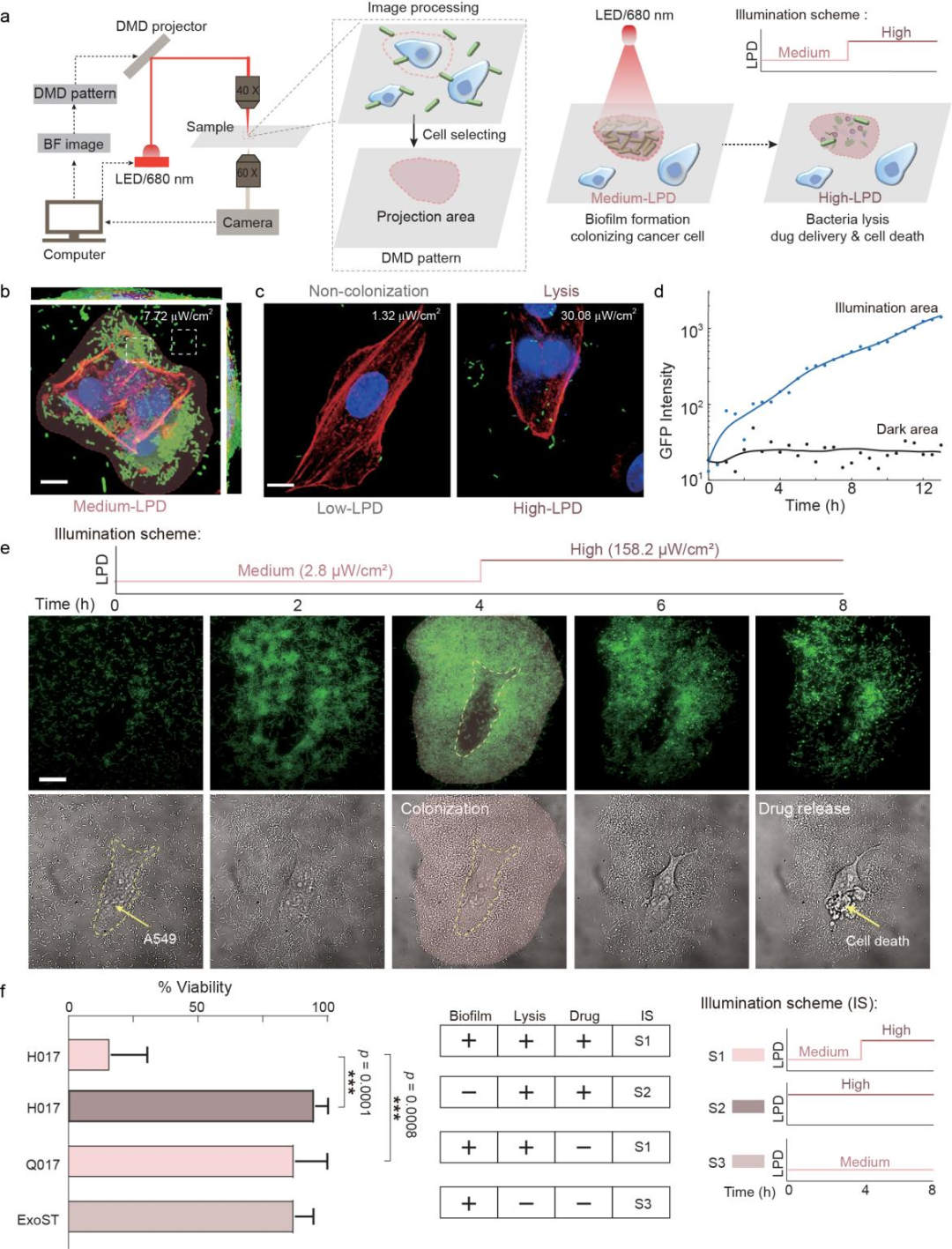 图3:编程细菌“生物被膜-裂解”生活方式转换实现药物的控制释放
图3:编程细菌“生物被膜-裂解”生活方式转换实现药物的控制释放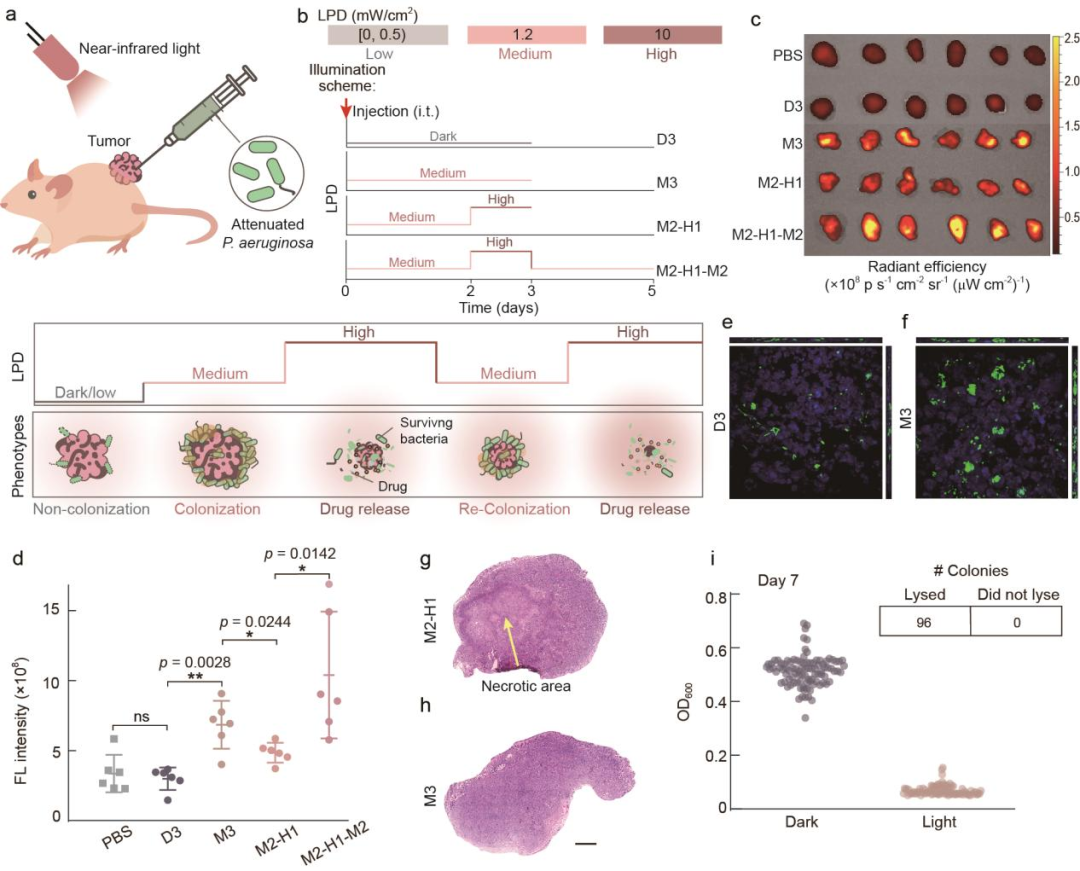 图4:通过近红外光操控实体瘤内的细菌生活方式
图4:通过近红外光操控实体瘤内的细菌生活方式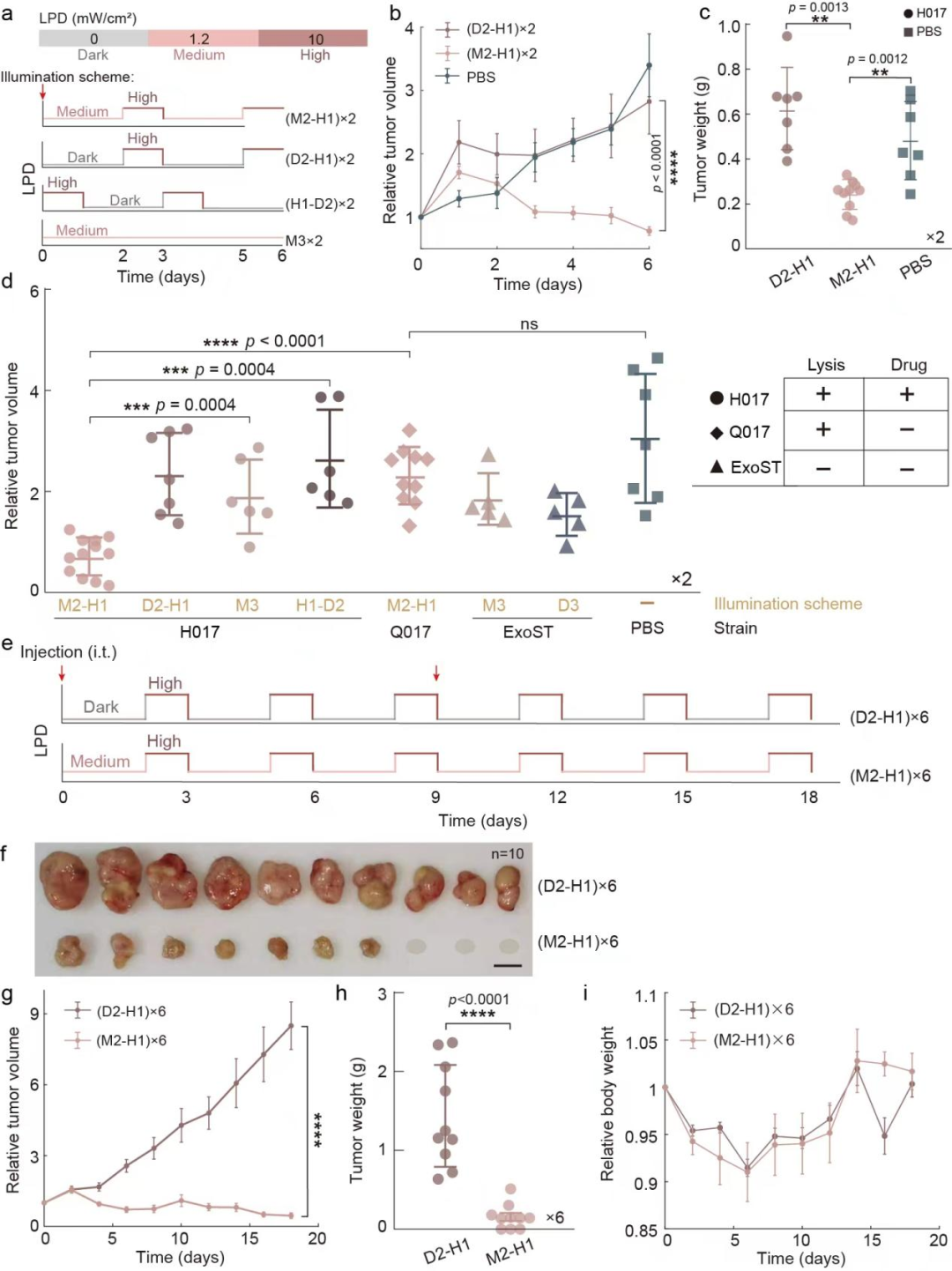
深圳先进院合成所助理研究员张荣荣为论文共同第一作者及共同通讯作者,金帆研究员为论文通讯作者。该研究得到国家科技部重点研发计划、国家自然科学基因,中国科学院科研仪器设备研制项目、中国博士后科学基金,长安私人资本、深圳合成生物学创新研究院等多个项目的支持,并得到了合成生物重大科技基础设施团队的大力协助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


