Nat Genet:科学家在“黑暗基因组”中发现能显著改善癌症T细胞疗法疗效的主要调节子
来源:生物谷原创 2023-11-23 15:32
来自杜克大学等机构的科学家们成功将CRISPR技术应用于人类免疫细胞基因功能的高通量筛选中,并发现基因组中的单一主要调节子或能被用来重编程T细胞中数千个基因网络,并能够能大大增强对癌细胞的杀伤能力。
对过继T细胞疗法的临床反应与细胞产物的转录和表观遗传学状态有关,因此,发现调节T细胞基因网络的调节自及其相应的表型或许具有改善T细胞疗法的潜力。近日,一篇发表在国际杂志Nature Genetics上题为“Transcriptional and Epigenetic Regulators of Human CD8 T cell Function Identified Through Orthogonal CRISPR Screens”的研究报告中,来自杜克大学等机构的科学家们成功将CRISPR技术应用于人类免疫细胞基因功能的高通量筛选中,并发现基因组中的单一主要调节子或能被用来重编程T细胞中数千个基因网络,并能够能大大增强对癌细胞的杀伤能力。
这种主要的调节因子被称为BATF3,其是研究人员发现并用来测试用于改善T细胞疗法的多个基因之一,这些靶点以及用来识别、测试和控制它们的方法,能制造出目前正在使用以及正在开发具有较大潜力的任何T细胞疗法,结合其它研究进展,这一研究平台或许就能实现通用且现成的治疗版本,并能扩展到治疗诸如自身免疫性疾病等其它疾病领域中。T细胞疗法在治疗癌症上已经有10年历史了,最近的版本主要涉及对免疫系统的主要士兵进行重编程从而寻找并摧毁其可能会被忽略的癌细胞,目前许多公司都在努力改进这项技术,主要是通过利用基因工程技术来指导T细胞如何识别癌细胞,并使其更加有效地摧毁它们。
目前已经有6种FDA批准的T细胞疗法用于治疗特定的白血病、淋巴瘤和多发性骨髓瘤,然而,尽管在某些研究中有一定成功的迹象,但这种方法在应用到实体瘤中时或许会表现不佳,实体瘤通常会给T细胞带来巨大的物理障碍,从让其无法克服,而呈现靶点的癌细胞的绝对数量和密度也会导致T细胞衰竭,并让攻击者变得筋疲力尽,以至于其无法发起机体的抗肿瘤反应。研究者Charles Gersbach说道,在某些情况下,T细胞疗法就像一种神奇的药物能发挥作用一样,但在大多数情况下其几乎没有任何作用。
目前研究人员正在寻找通用的解决方案,通过重编程其基因调节软件,而不是重写或破坏其遗传硬件,从而就会使得这些细胞变得更好;这种证明或许就是克服主要障碍的关键一步,从而就会使得T细胞疗法能在更多癌症类型患者中发挥一定的作用。研究者Gersbach及其实验室在过去多年里一直在研发一种技术,其能利用基因编辑技术CRISPR-Cas9的一个版本,在不对基因进行切割的情况下探索并调节基因,相反,其能改变包装和储存DNA的结构并影响伴随基因的活性水平。研究人员重点研究了“黑暗基因组”(dark genome)区域,这些区域会随着T细胞在不同状态(比如功能和耗竭)之间的转变而发生变化,研究人员识别出了120个编码主要调节子的基因,这些基因主要负责许多其它基因的活性水平,利用CRISPR平台,研究人员就能调节这些靶点的活性水平,从而观察其如何影响T细胞功能的其它已知标志物。
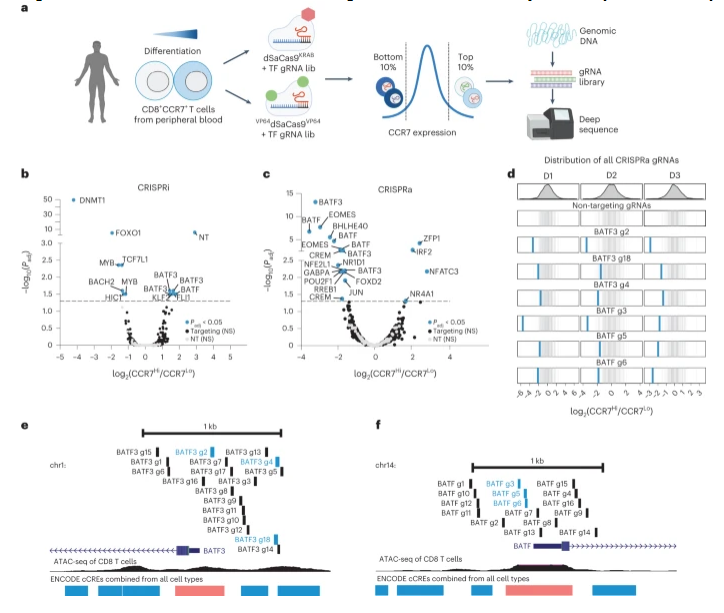
科学家在“黑暗基因组”中发现能显著改善癌症T细胞疗法疗效的主要调节子。
图片来源:Nature Genetics (2023). DOI:10.1038/s41588-023-01554-0
尽管出现了多个有希望的候选基因,但其中最有希望的一种就是名为BATF3的基因,当研究人员将BATF3直接传递给T细胞时,T细胞中DNA的包装结构就会发生数千次调整,这或许就与T细胞潜能的增强及对耗竭的耐受存在直接关联。目前使用T细胞来对抗癌症的一个已知障碍就是,随着时间推移T细胞会变得疲劳,从而失去杀死癌细胞的能力,如今他们正在通过模拟在临床产品中表现良好的自然发生的细胞状态,从而确定使T细胞变得更加强大以及更有“弹性”的操作方法。
研究人员还对BATF3进行了一系列测试,当其在小鼠模型的T细胞中过度表达BATF3基因从而来攻击人类乳腺癌肿瘤时,最有趣的结果出现了,尽管标准的T细胞疗法难以减缓肿瘤的生长,但同样剂量的携带BATF3的工程化改造T细胞则能完全清除肿瘤。尽管BATF3的 相关研究结果让研究人员非常兴奋,但他们更热衷于阐明能确定和调节主要调节子从而改善治疗效果的方法的总体成功,如今他们已经花费了近10年的时间来进行研究开发。目前研究人员能利用任何T细胞来源和癌症模型,并在模拟临床条件的多种实验条件下,很容易地分析T细胞适应性的主要调节子。
在本文研究的最后一部分,研究人员筛选了携带或并不携带BATF3的T细胞,同时还利用CRISPR技术移除了基因表达的所有其它主要调节子,共有超过1600个调节子,这或许就会导致一组全新因子的发现,这些因子能单独靶向作用或与BATF3相结合来增加T细胞疗法的治疗潜力。这项研究的重点是通过进行CRISPR筛选来确定一个特定的靶点,但如今研究人员或许进一步对不同的模型和肿瘤类型进行了相关研究。
研究人员提出了许多能应用于这种方法来增强T细胞疗法的策略,包括从利用患者自身的T细胞到拥有用于多种类型癌症的广义T细胞库,他们希望这些技术能普遍用于所有策略。综上,本文研究结果表明,研究人员进行了CRISPR敲除筛选从而确定了BATF3基因网络的辅助因子和下游介质。(生物谷Bioon.com)
原始出处:
McCutcheon, S.R., Swartz, A.M., Brown, M.C. et al. Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens. Nat Genet(2023). doi:10.1038/s41588-023-01554-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


