中国团队8项消化道和头颈肿瘤重磅研究登陆2022 ASCO
来源:奇点糕 2022-06-08 10:00
2022 ASCO第六弹,我们为大家带来了胃肠道(结直肠、肛门、胃食管、胰腺和肝胆)癌领域和头颈癌领域的10项重要研究进展,其中8项来自中国研究团队。
2022 ASCO第六弹,我们为大家带来了胃肠道(结直肠、肛门、胃食管、胰腺和肝胆)癌领域和头颈癌领域的10项重要研究进展,其中8项来自中国研究团队。
3510
纳武利尤单抗(NIVO)±伊匹木单抗(IPI)在微卫星不稳定性高/错配修复缺陷(MSI-H/dMMR)转移性结直肠癌(mCRC)患者(pts)中的应用:来自CheckMate 142的5年随访
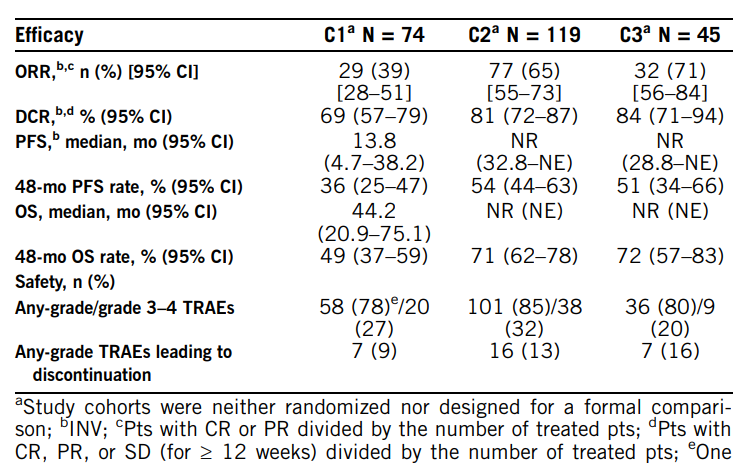
基于2期CheckMate 142研究(NCT02060188)结果,NIVO±IPI在美国、欧盟和日本被批准用于经治的MSI-H/dMMR mCRC患者。美国国立综合肿瘤网络(NCCN)指南将NIVO+IPI作为MSI-H/dMMR mCRC患者的初始治疗方案。本次研究报道了来自CheckMate 142队列1–3(C1-3)的5年随访结果。
在这项非随机、多队列研究中,MSI-H/dMMR mCRC患者接受如下治疗:C1[2线及以上(2L+);NIVO 3mg/kg Q2W]、C2 [2L+;NIVO 3mg/kg+IPI 1mg/kg Q3W(4剂),序贯NIVO 3mg/kg Q2W]和C3[1线(1L);NIVO 3mg/kg Q2W+IPI 1mg/kg Q6W],直至疾病进展或出现不可接受的毒性反应。主要终点是根据实体瘤疗效评价标准(RECIST)v1.1由研究者评估(INV)得到的客观缓解率(ORR)。其他关键终点是疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS),全部经由INV和盲法独立中心审查;以及总存活率(OS)和安全性。
在C1(N=74)、C2(N=119)和C3(N=45)队列,中位随访时间(从首次给药到数据截止)分别为70.0(66.2-88.7)、64.0(60.0-75.8)和52.4(47.6-57.1)个月。C1、C2和C3的ORR(95%CI)分别为39%(28-51),65%(55-73)和71%(56-84;见下表),疾病进展(PD)率分别为26%、12%和16%。3组均没有达到中位DOR。C1、C2和C3的48个月PFS率分别为36%、54%和51%,48个月的OS率分别为49%、71%和72%(见下表)。未来将报告随访60个月的PFS和OS率。安全数据如表所示。
在大约5年的长期随访中,NIVO±IPI继续显示出持续的OS和PFS获益,没有新的安全性时间。这些更新的数据进一步支持了目前对MSI-H/dMMR mCRC患者的2L+NIVO±IPI和1L NIVO+IPI的治疗推荐。
3609
北京大学肿瘤医院武爱文教授团队:全程新辅助放化疗联合新辅助PD-1抑制剂,为pMMR/MSS局部晚期中低位直肠癌治疗提供潜在新范例
诱导化疗和放化疗的全程新辅助治疗(TNT)是局部晚期直肠癌的标准治疗方法。对于错配修复缺陷(dMMR)患者,在新辅助治疗中结合程序性死亡受体1(PD-1)抑制剂是有希望的方法,但TNT联合PD-1抑制剂对错配修复正常/微卫星稳定(pMMR/MSS)患者的疗效尚不清楚。此研究的目的是评估新辅助PD-1抑制剂联合TNT治疗pMMR/MSS局部晚期直肠癌患者的临床获益情况。
研究人员设计了一项关于局部晚期dMMR/MSS直肠癌的前瞻性、单臂、II期试验(PKUCH 04试验)。患者接受3个周期的新辅助方案(PD-1抑制剂,卡瑞利珠单抗,也称为SHR-1210,200mg d1,奥沙利铂130mg/m2 d1,卡培他滨1250mg/m2 bid d1-d14),然后接受长疗程化放疗[调强放射治疗(IMRT,1.8Gy/F*25F)],如无疾病进展,则再接受2个周期的CapeOx 方案化疗(奥沙利铂130mg/m2 d1,卡培他滨1250mg/m2 bid d1-d14,q3wks)。主要终点是病理完全缓解(pCR)率,次要终点包括不良事件和手术并发症。肿瘤评估在诱导后、化放疗和决定手术或观察和等待之前进行。
共筛选了27例患者,最终25例患者符合进一步分析的条件,中位年龄58岁(31-70)。距肛门边缘的中位距离为5.3cm(1.2-10cm)。76%为男性,76%为N2,56%为直肠系膜筋膜(MRF)阳性,80%为肠壁外血管浸润(EMVI)阳性。所有患者都完成了诱导期和化放疗期治疗。21例患者行全直肠系膜切除(TME)手术,其中7例病理完全缓解(33.3%)。4例患者达到临床完全缓解或接近完全缓解,并选择观察和等待。7例主要病理缓解(超过90%的缓解)。另有7例部分病理缓解。没有发现进行性疾病。14例为低位前切除术(LAR),7例为经腹会阴联合直肠癌切除术(APR)。手术并发症发生率为14.3%,死亡率为0。常见的不良事件包括恶心(80%)、淋巴细胞减少(80%)、感觉异常(76%)、反应性皮肤毛细血管内皮增生(72%)、中性粒细胞减少(68%)。3级不良事件包括淋巴细胞减少症(24%)、腹泻(8%)和血小板减少(4%),未观察到4级或5级事件。直到2022年1月,没有发现复发或肿瘤再生。
全程新辅助化放疗联合新辅助PD-1抑制剂治疗pMMR/MSS直肠癌安全有效,可获得良好的肿瘤退缩和保肛效果。研究为pMMR/MSS局部晚期直肠癌的治疗提供了一个潜在的新范例,需要进一步的研究。
4013
中山大学肿瘤防治中心李少华团队:术后辅助性肝动脉灌注化疗(HAIC)联合FOLFOX可改善肝细胞癌微血管侵犯患者的预后
中山大学肿瘤防治中心研究团队在此次会议报道了术后辅助性HAIC联合FOLFOX(5-氟尿嘧啶、亚叶酸钙和奥沙利铂)治疗微血管侵犯(MVI)肝细胞癌(HCC)患者的疗效和安全性数据。
在这项随机、开放标签、多中心的3期临床试验中,经病理确诊有MVI的HCC患者被随机(1:1)分配到治疗组(1-2个周期的HAIC-FOLFOX)与对照组(不接受任何辅助治疗,仅随访)。研究的主要终点是无病生存期(DFS),次要终点是总生存(OS)率、复发率和安全性。生存率使用Kaplan-Meier方法计算。不良事件(AE)按NCI-CTCAE 5.0版本进行分级。
自2016年6月至2021年8月,共有5个中心的315名患者被纳入研究,其中治疗组157例,对照组158例,这些患者被纳入了意向性分析(ITT)。其中,14例治疗组患者和15例对照组患者因未完成既定治疗方案而被排除在遵循研究方案(PP)分析之外。治疗组有148例患者进行至少1个周期的HAIC治疗,这部分患者被纳入安全性分析。在ITT分析中,治疗组和对照组的中位DFS分别为27.0月(95%CI:17.0-37.0)和11.3月(95%CI:7.9-14.7),而在PP分析中,中位DFS则分别为20.4月(95%CI:9.5-31.3)和9.7月(95%CI:6.9-12.4)。无论是ITT分析还是PP分析中,治疗组的DFS均明显优于对照组(P=0.001,P<0.001)。在ITT分析中,治疗组患者的1、2、3年DFS率分别为64.3%、50.4%、44.3%,对照组患者分别为47.3%、33.3%、24.2%。在PP分析中,治疗组患者的1、2、3年DFS率分别为64.0%、48.2%、42.2%,对照组患者分别为43.3%、27.1%、18.4%。在ITT分析中,治疗组患者1、2、3年OS率分别为94.7%、87.6%、80.5%,对照组患者分别为91.9%、85.9%、77.0%。在PP分析中,治疗组患者1、2、3年OS率分别为94.9%、86.7%、80.9%,对照组患者分别为91.8%、84.9%、75.3%。此外,在ITT分析中,治疗组有63例(40.1%)患者肿瘤复发,对照组有88例(55.7%)患者肿瘤复发。试验中观察到的大多数不良反应为0-1级(n=124,83.8%),在研究期间没有观察到与治疗相关的死亡事件。
术后辅助性HAIC联合FOLFOX可显著提高有MVI的HCC患者的生存率,且治疗的毒副作用可接受。
4016
山东省肿瘤医院孟雪团队:尼妥珠单抗联合放化疗vs单纯放化疗在无法切除的局部晚期食管鳞癌(ESCC)患者中的疗效和安全性分析
70%的食管癌患者在确诊时就已经失去了手术机会。尽管临床上对ESCC的治疗进行了许多研究,但晚期患者的长期存活率仍然很低,5年存活率仅为30%-40%。山东省肿瘤医院孟雪团队开展了一项前瞻性、随机对照、双盲、多中心的3期研究(NXCEL1311),目的是比较尼妥珠单抗联合同步放化疗与安慰剂+放化疗在局部晚期不能切除的ESCC患者中的疗效和安全性。
该研究中,无法切除的局部晚期ESCC患者被随机(1:1)分配到尼妥珠单抗组(400 mg,qw)或安慰剂组,并联合放化疗(紫杉醇+顺铂+3DCRT/IMRT),疗程7周,随访时间为5年。研究主要终点为总生存(OS)率,次要终点为客观缓解率(ORR)、疾病控制率(DCR)和无进展生存期(PFS)。
研究共纳入200例患者,其中尼妥珠单抗组99例,安慰剂组101例。在完成6个月的随访后,研究人员对短期疗效,如次要终点(ORR,DCR)和安全性进行了中期分析。目前的数据不足以分析OS。两组患者具有相似的基线特征。80例尼妥珠单抗组患者和82例安慰剂组患者可进行疗效评估。结果显示,尼妥珠单抗组的ORR(75/80,93.8%)显著高于安慰剂组(59/82,72.0%)(P<0.001)。尼妥珠单抗组中有26例患者达到完全缓解(CR),安慰剂组有10例患者达到CR。尼妥珠单抗组的CR率显著高于安慰剂组(32.5% vs. 12.2%,P=0.002)。尼妥珠单抗组和安慰剂组的DCR分别为98.8%(79/80)和91.5%(75/82)(P=0.064)。单因素logistic分析显示,年龄、性别、病变数目和BMI对ORR、CR和DCR无显著影响(P>0.05)。多因素校正分析显示,两组的CR、ORR和DCR差别分别为20%(95%CI:6.0%-40.2%)、30%(95%CI:10.6%-52.1%)和10%(95%CI:5.2%-31.1%)。3-5级药物相关不良反应发生率分别为11.1%和10.9%(P>0.05)。尼妥珠单抗加放化疗治疗的患者常见的药物相关不良反应有白细胞减少、中性粒细胞减少、血小板减少、血红蛋白降低、骨髓抑制、营养性贫血和放射性炎症。
NXCEL1311研究中期分析显示,尼妥珠单抗联合放化疗是安全的,且可改善患者的CRR和ORR。OS的比较则需要继续进行随访并进行最终的分析。
4017
北京大学肿瘤医院齐长松团队:CAR-T细胞疗法(CT041)在CLDN18.2阳性晚期胃/胃食管连接癌患者中的应用
Claudin18.2(CLDN18.2)是一种很有前景的治疗靶点,在正常生理状态下,CLDN18.2仅在胃粘膜上已分化的上皮细胞中表达,但在胃/胃食管连接(G/GEJ)癌中也存在高表达。CT041,一种精准靶向CLDN18.2的CAR-T细胞疗法,在临床前研究中显示出良好的抗肿瘤活性。最近一项1期临床研究结果显示,CT041的耐受性良好,在先前接受过治疗的CLDN18.2阳性晚期G/GEJ癌症患者中显示出了良好的疗效。在此次会议,北京大学肿瘤医院齐长松团队报道了一项正在进行的1b/2期研究(CT041-ST-01,NCT04581473),主要探讨了CT041在G/GEJ癌症患者中的初步疗效和安全性结果。
该开放标签、双阶段、多中心1b/2期研究的目的是评估CT041在经治CLDN18.2阳性的晚期G/GEJ癌症患者中的疗效和安全性。这项研究包括剂量递增/剂量扩大阶段(1b)和安全性/有效性确认阶段(第二阶段)。在剂量升级/降级阶段,采用3+3设计研究2.5x108和3.75x108的CT041剂量水平。1b期部分的主要目标是确定CT041的安全性、耐受性和推荐的2期剂量(RP2D)。数据收集截至2021年12月22日。
从2020年11月至2021年5月,共有14例符合条件的G/GEJ癌症患者纳入1b期研究,中位年龄44.5岁(23-71),85.7%的患者先前接受过2次治疗,14.3%的患者至少接受过3次治疗。57.1%的患者有≥3个转移器官,其中92.9%有腹膜播散,64.3%的患者出现印戒细胞癌。在纳入研究的患者中,其中3人接受3.75x108剂量水平治疗,11人接受2.5x108剂量水平治疗(最多3次)。最常见3级以上不良反应是与淋巴耗竭有关的血液毒性。没有观察到剂量限制性毒性、与治疗相关的死亡、神经毒性或胃肠道毒性。患者中发生的细胞因子释放综合征(CRS)分级多为1级或2级,仅1例患者出现4级CRS并完全恢复。到数据截止点,14例患者中有8例(57.1%)达到部分缓解(PR),2例患者(14.3%)病情稳定(SD)。患者的中位随访时间为8.9月(95%CI:5.91-NE),中位无进展生存期为5.6月(95%CI:1.9-7.4),中位总生存期为10.8个月(95%CI:5.1-NE)。
这些初步结果表明,CT041在经治晚期G/GEJ癌症患者中具有可控的安全性/耐受性和良好的疗效。这项研究正在进行中,第二阶段对CT041的进一步评估正在进行中。
4023
CPI-613联合改良FOLFIRINOX(mFFX)化疗方案与标准FOLFIRINOX(FFX)化疗方案在转移性胰腺癌患者中的疗效和安全性分析
目前,转移性胰腺癌(mPC)患者的治疗选择很有限,预后极差。FFX是治疗mPC的标准一线疗法,经FFX治疗后,中位总生存期(mOS)为11.1月。CPI-613可抑制肿瘤细胞线粒体内三羧酸循环中的丙酮酸脱氢酶和α-酮戊二酸脱氢酶,从而影响肿瘤细胞的增值和存活。1期临床研究显示,CPI-613+mFFX用于mPC治疗是安全的,并显示出良好的治疗效果。
这是一项多中心的全球随机3期临床试验,目的是比较CPI-613联合mFFX(试验组)与标准剂量FFX(对照组)用于初治mPC患者的疗效和安全性。研究中1个治疗周期为2周,治疗持续到患者病情进展或出现无法忍受的毒性反映。试验组第1、3天静脉注射CPI-613 500 mg/m2。试验组伊立替康、奥沙利铂和5-氟尿嘧啶的剂量分别为65 mg/m2、140 mg/m2和2400 mg/ m2。研究的主要终点是总生存期(OS),次要终点为无进展生存期(PFS)、总体缓解率(ORR)、有效持续时间、药代动力学和安全性数据。
试验共纳入528例患者,随机分为试验组(n=266)和对照组(n=262)。CPI613+mFFX组中位OS为11.1个月,而FFX组中位OS为11.7个月(HR:0.95,95% CI:0.77-1.18,P=0.655)。CPI613+mFFX组和FFX组的中位PFS分别为7.8个月与8.0个月(HR:0.99,95% CI:0.76-1.29,P=0.94)。CPI613+mFFX组和FFX组的ORR分别为39%和34%(ORR比值:1.23,95% CI:0.86-1.75)。CPI613+mFFX组与FFX组发生频率≥10%的3级以上不良事件包括腹泻(11.2% vs. 19.6%)、低钾血症(13.1% vs. 14.9%)、贫血(13.9% vs. 13.6%)、中性粒细胞减少(11.2% vs. 14.0%)、血小板减少(11.6% vs. 13.6%)和疲劳(10.8% vs. 11.5%)。
总的来说,相比于FFX,CPI-613联合mFFX并未能显著改善mPC患者的ORR、PFS或OS。试验组中mFFX使用了标准FFX的最低剂量,但患者的PFS或OS并没有变差,这一结果可作为未来FFX给药剂量的参考。
4040
解放军总医院第五医学中心徐建明团队:KN026单药在晚期经治HER2阳性胃或胃食管连接(G/GEJ)癌患者中的应用
晚期G/GEJ癌症患者二线及后线治疗预后较差。KN026是一种新型靶向HER2的双特异性抗体,可同时结合HER2的两个非重叠表位,达到曲妥珠单抗和帕妥珠单抗联用的效果。KN026在临床前和1期研究中显示出良好的抗肿瘤效果。在此次会议,解放军总医院第五医学中心的徐建明教授团队介绍了KN026单药在经治HER2阳性晚期G/GEJ癌症患者中的疗效。
在这项多中心、单臂的2期临床研究中,经治晚期G/GEJ癌症患者根据HER2表达水平,被分成HER2高表达组(队列1:IHC 3+或IHC 2+ ISH+)和HER2低表达组(队列2:IHC 1+/2+ ISH-或IHC 0/1+ ISH+)。KN026按10 mg/kg qw、20 mg/kg q2w或30 mg/kg q3w静脉滴注给药。研究的主要终点是根据RECIST 1.1评估的客观缓解率(ORR)和有效持续时间(DoR),次要终点包括无进展生存期(PFS)、总生存期(OS)和安全性。
截止2021年10月29日,共有45例患者入选试验并接受KN026治疗,其中39例可纳入疗效评价标准(队列1有 25例,队列2 有14例)。队列1的ORR为56%(95%CI:35%-76%),其中取得部分缓解(PR)14例,中位DoR为9.7月(95%CI:4.2-NE),患者的中位随访时间为14.7月(95%CI:9.4-16.5),中位PFS为8.3月(95%CI:4.2-11.4),中位OS为16.3月(95%CI:11.0-NE)。队列2的ORR为14%(95%CI:2%-43%),中位DoR为6.2月(95%CI:3.2-NE),在中位随访时间为27.5月(95%CI:4.1-NE),中位PFS为1.4月(95%CI:1.4-4.1),中位OS为9.6月(95%CI:3.5-14.9)。表中显示了队列1中KN026在既往经曲妥珠单抗治疗后出现疾病进展的患者中的疗效。37例患者(82%)出现KN026相关不良事件(TRAE),最常见的TRAE(任何级别)为天冬氨酸氨基转移酶升高(27%)、丙氨酸氨基转移酶升高(20%)、皮疹(16%)、贫血(16%)和输液相关反应(16%)。4例患者发生了5次3级TRAE,包括输液相关反应、肾积水、输尿管狭窄、血压升高和肝功能异常各1例,无4级或5级TRAE发生。
KN026单药在晚期经治HER2阳性的G/GEJ癌症患者中效果良好,未来仍需进行进一步的研究分析。

4052
浙江省肿瘤医院俞鹏飞团队:白蛋白结合型紫杉醇联合S-1(AS)方案与卡培他滨联合奥沙利铂(CapeOX)方案在D2根治术后晚期胃癌患者中的应用
目前尚无前瞻性研究评估紫杉醇联合氟嘧啶与铂类联合氟嘧啶在晚期胃癌辅助化疗中的疗效。来自浙江省肿瘤医院的俞鹏飞团队探讨了白蛋白结合型紫杉醇(Nab-p)联合替吉奥(S-1)组成的AS方案与奥沙利铂联合卡培他滨组成的CapeOX方案在胃腺癌患者中的有效性和安全性。
试验将接受D2根治术并达到R0切除的III期胃或胃食管连接腺癌患者按照1:1的比例随机分为AS组和CapeOX组,并按分化类型(分化与未分化)和AJCC/UICC病理分期(IIIA与IIIB,IIIC)进行分层分析。AS组:第1、8天白蛋白结合型紫杉醇 100 mg/m2;第1-14天S-1 80~120 mg/d,口服一日两次,每21天为1周期,共8个周期。CapeOX组:第1天奥沙利铂130 mg/m2;第1-14天卡培他滨1000 mg/m2,口服一日两次;每21天为1周期,共8个周期。研究的主要终点是3年无病生存(3年DFS)率,次要终点包括总生存期(OS)和安全性。
从2020年3月至2022年1月,共有146名患者纳入研究,其中AS组71例, CapeOX组75例。两个组之间的基线特征相似。AS组和CapeOX组1年DFS率分别为95.50%和72.84%。到截止日,AS组有3例患者出现复发(腹膜1例,局部复发1例,远处复发1例),而CapeOX组有10例患者出现复发(腹膜2例,局部复发4例,远处复发4例)。AS组死亡0例,而CapeOX组死亡4例。42例患者(AS组21例,29.58%;CapeOX组21例,28.00% )由于血液毒性需要减少治疗剂量。在接受AS方案的297个治疗周期中(截止数据收集时,所有AS组患者治疗周期相加,部分患者治疗尚在进行中或因毒副作用等终止治疗而不满8个周期),有82个治疗周期出现延迟治疗(27.61%,24次因血液毒性,15次因非血液毒性),CapeOX组319个治疗周期中有100个治疗周期出现延迟治疗(31.35%,18次因血液毒性,13次因非血液毒性)。AS组和CapeOX组分别有34例(47.89%)和30例(40.00%)患者发生治疗相关不良事件(TRAE),但多为1-2级。主要的3-4级不良反应为中性粒细胞减少(AS组28.16% vs. CapeOX组8.00%)、白细胞减少(15.49% vs. 1.33%)、血小板减少(0% vs. 8.00%)和贫血(5.63% vs. 1.33%)。
与CapeOX方案相比,AS方案有改善患者DFS的趋势,是治疗D2根治术后III期胃癌患者的潜在方案,且毒性可耐受。AS方案对患者的长期生存影响需要更多数据来进行评估。
6027
中国医学科学院北京协和医学院团队:派安普利单抗联合安罗替尼一线治疗含铂化疗失败后复发或转移的头颈部鳞状细胞癌的2期研究数据
派安普利单抗是一种新型的人免疫球蛋白G1(IgG1)抗程序性细胞死亡受体1(PD-1)抗体。通过修饰可结晶片段以避免FcγR结合,完全消除了抗体依赖性细胞介导的细胞毒性和抗体依赖性细胞吞噬作用的影响。
ALTN-AK105-II-01(NCT04203719)是一项单臂、多队列、多中心2期研究,旨在探索派安普利单抗联合安罗替尼(一种同时抑制血管生成和肿瘤细胞增殖的多激酶抑制剂)在治疗各种晚期癌症中的疗效和安全性。在此,研究报告了队列1研究中复发性或转移性头颈部鳞状细胞癌(R/M HNSCC)患者(pts)的结果。
符合条件的患者经组织学确诊为R/M HNSCC,且至少有一线铂类化疗方案失败。其他入组标准包括年龄大于或等于18岁,ECOG PS 0-1,既往未使用抗血管生成药物或免疫检查点抑制剂治疗。患者接受派安普利单抗200mg静脉注射d1,并口服安罗替尼12mg,每天一次,每3周d1~d14,直到疾病进展或出现不可接受的毒性。主要终点是实体瘤疗效评价标准(RECIST)1.1的客观缓解率(ORR)。次要终点包括无进展生存期(PFS)、总生存期(OS)、疾病控制率(DCR)、缓解持续时间(DoR)和安全性。
从2020年6月1日至2021年11月22日,中国8个中心共38例受试者入组。原发肿瘤的部位包括口腔(15/38,42.9%)、口咽(6/38,15.8%)、下咽(4/38,4.5%)、喉(10/38,26.3%)和其他(3/38,7.9%)。截至2022年1月6日(数据截止),研究达到了主要终点,即13例患者达到部分缓解(PR),ORR(首次缓解后至少4周确认)为34.21%。14例患者达到持续至少4周的疾病稳定(SD),DCR为76.32%。在中位随访6.96个月后(95%CI,4.40~8.80),17例患者中观察到PFS事件,中位PFS为8.35个月(95%CI,5.45~13.11)。6个月时的PFS率为62.5%。9例患者死亡,未达到中位OS(95%CI,9.43~NE)。有肿瘤缓解的患者未达到中位DoR(95%CI,2.37~NE)。89.47%的患者发生了治疗相关不良事件(TRAEs),39.47%的患者发生了3级或以上的TRAEs。最常见的TRAEs是高血压(28.95%)和甲状腺功能减退(28.95%)。
在标准一线治疗失败的R/M HNSCC患者中,联合使用派安普利单抗和安罗替尼显示出有希望的疗效和可控制的毒性。需要进一步研究。
6068
中山大学肿瘤防治中心陈秋燕团队:新辅助化疗联合替雷利珠单抗后序贯同步放化疗治疗局部晚期鼻咽癌患者的2期研究数据
在同步放化疗(CCRT)前采用吉西他滨联合顺铂(GP)的新辅助治疗对局部晚期鼻咽癌(LANPC)患者具有良好的生存预后,且毒性可接受,其中10%的患者在新辅助治疗后达到完全缓解(CR)。免疫检查点抑制剂加GP方案已被证明可提高复发或转移NPC患者的生存率。此研究讨论了GP联合替雷利珠单抗[一种抗程序性死亡受体1(PD-1)单克隆抗体]新辅助治疗初治LANPC患者的有效性和安全性。
在这项II期单臂Simon两阶段研究中,符合条件的患者年龄为18-70岁,具有良好的血液、肾脏和肝脏功能,诊断为III-IVa期(AJCC第8版)非角质型LANPC。入组患者接受静脉注射吉西他滨(1000 mg/m²,d1和d8),顺铂(80 mg/m²,d1),替雷利珠单抗(200mg,d1),每3周一次,共3个疗程,随后序贯标准CCRT。主要终点是新辅助治疗后的CR率,使用实体瘤疗效评价标准(RECIST)1.1版进行评估。次要终点包括病理完全缓解(pCR)率、2年无进展生存期(PFS)、总生存期(OS)、局部区域无复发生存期(LRRFS)、远处无转移生存期(DMFS)和毒性。研究注册号为NCT04833257,所有入组患者均已完成治疗,随访正在进行中。
从2021年4月14日至2021年8月5日,共有63例患者(中位年龄46岁,74.6%为男性)在中山大学肿瘤中心入组。截至2022年1月31日,中位随访时间为7.37个月,无患者出现疾病进展。新辅助治疗后的CR率为41.3%(95%CI,28.8%~53.8%)。ORR和pCR率分别为88.9%(95%CI,80.9%~96.9%)和75.8%(95%CI,64.8%~86.8%)。3级或4级急性治疗相关不良事件(trAEs)和免疫相关不良事件(irAEs)的发生率分别为69.8%和3.2%。所有3级或4级的irAEs均为肝毒性和皮疹。长期疗效有待观察。
GP联合替雷利珠单抗的新辅助治疗取得了显著的CR率和pCR率,且毒性可控。需要进一步随访以确认长期疗效。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


