Genes & Development:研究揭示组蛋白伴侣sNASP-ASF1协同与竞争结合组蛋白H3-H4的分子机制
来源:生物物理研究所 2021-11-30 08:16
中国科学院生物物理研究所许瑞明团队在Genes & Development上,在线发表了题为Distinct histone H3-H4 binding modes of sNASP reveal the basis for cooperation and competition of histone chaperones的研
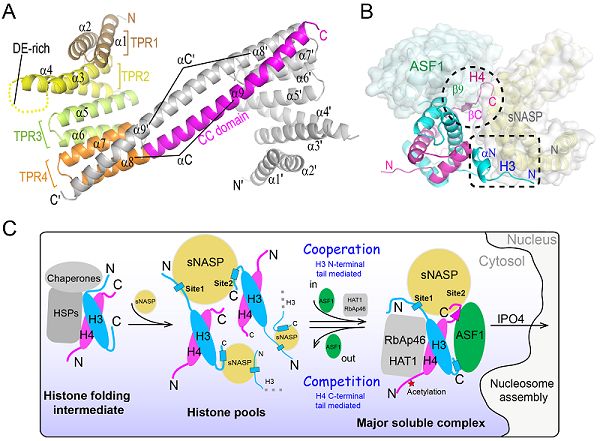
中国科学院生物物理研究所许瑞明团队在Genes & Development上,在线发表了题为Distinct histone H3-H4 binding modes of sNASP reveal the basis for cooperation and competition of histone chaperones的研究论文。该研究揭示了组蛋白伴侣sNASP-ASF1结合组蛋白H3-H4的协同与竞争机制,为阐释组蛋白H3-H4的结合模式及其在组蛋白伴侣网络间的传递提供了新视角。
组蛋白伴侣作为调控染色质组装的重要因子,与真核细胞表观遗传信息的提取与传递紧密相关,其功能异常会影响染色质正确组装,进而影响DNA复制与基因转录、基因组稳定和细胞重编程等生物学过程。此前,科研团队解析了组蛋白伴侣HJURP特异性识别着丝粒区组蛋白变体CENP-A的结构机理(Genes & Development,2011);揭示了组蛋白变体H3.3被其伴侣蛋白DAXX精确识别的结构基础(NSMB,2012),阐明了Asf1调控组蛋白乙酰化修饰的分子机制(Cell,2018)。然而,关于另一类伴侣蛋白sNASP如何在细胞中结合和存储组蛋白H3-H4以及组蛋白H3-H4如何在伴侣网络中接力传递,其分子机制尚不清楚。这一成果是在该研究方向的重要进展。
该研究发现了人源组蛋白伴侣sNASP在体外同时存在单体和二聚体两种形式,并解析了sNASP TPR结构域二聚体2.9?的晶体结构。该结构显示sNASP的TPR4 motif中的α8和Coiled-Coil domain(α9)形成一个超长螺旋αC,介导了sNASP二聚体的形成(图A)。αC不参与结合组蛋白H3-H4,但缺少该段结构域,将严重影响核小体的组装。研究团队解析了sNASP-ASF1-H3-H4四元复合物3.0?的晶体结构,复合物结构显示sNASP以单体形式存在于复合物中,介导sNASP二聚体形成的超长螺旋αC不再与邻近分子配对,而是一分为二(α8和α9),并以180度大转弯折回与自身配对;ASF1通过底物组蛋白H3-H4作为媒介,与sNASP间接作用;sNASP与组蛋白H3-H4之间的相互作用位点主要有两处——H3的N端尾巴中的αN和H4的C端尾巴(图B)。结合体外生化实验和体内细胞荧光共定位技术发现,在ASF1存在的情况下,H3的N端尾巴对于sNASP的结合至关重要。H4的C端尾巴对sNASP的相互作用只起到辅助作用,但当缺少H4的C端尾巴时,ASF1将被踢出去,形成sNASP-H3-H4三元复合物。这提示H4的C端尾巴可以介导组蛋白H3-H4在sNASP-ASF1之间的传递。此外,研究还发现,在没有ASF1的情况下,sNASP以全新的方式结合组蛋白H3-H4。此时的组蛋白H3-H4主要通过其核心区域与sNASP的TPR4 motif以及位于TPR2 motif中间的酸性loop区域存在相互作用。根据论文实验结果并结合先前研究,科研人员提出了组蛋白H3-H4在伴侣网络中接力传递的模式图(图C)。该图全面展示了细胞质中新合成的组蛋白H3-H4通过一系列伴侣蛋白的接力传递,最终进入细胞核进行染色质组装的途径。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


