躺赚1亿美元,CRISPR基因编辑疗法获批上市,张锋创立的Editas坐收专利费
来源:生物世界 2023-12-15 13:41
在11名严重镰状细胞病患者和6名输血依赖性β-地中海贫血患者中,Reni-cel疗法的安全性与白消安和自体造血干细胞移植的清髓性预处理一致,未报告与Reni-cel疗法相关的严重不良事件。
2023年12月8日,美国FDA批准了首个CRISPR基因编辑疗法Casgevy上市,用于治疗治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病(SCD)患者。该疗法最初由CRISPR Therapeutics于2018年启动,此后与Vertex Pharmaceuticals合作推进。
随着Casgevy的获批上市,围绕在CRISPR-Cas9的专利争议也不得不再次被讨论。
几天后,Vertex Pharmaceuticals宣布将向张锋创立的基因编辑疗法开发公司Editas Medicines支付1亿美元,外加潜在许可费,以获取其CRISPR-Cas9基因编辑技术的非独家授权,用于包括Casgevy在内的针对镰状细胞病和β-地中海贫血的BCL11A基因的体外基因编辑药物。
据悉,Editas将收到来自Vertex的5000万美元预付款,还有资格通过或有支付获得另外5000万美元,但双方没有透露触发这笔5000万美元或有支付的条件。此外,Editas还有机会在2034年专利到期之前,每年获得1000-4000万美元的专利许可费。
CRISPR-Cas9专利之争
自2012年CRISPR-Cas9基因编辑技术诞生以来,就伴随着专利争议。专利争议主要来自两方,一方是Emmanuelle Charpentier和Jennifer Doudna(简称CVC团队);另一方是张锋所在的Broad研究所。

他们三人被称为CRISPR三巨头,Emmanuelle Charpentier和Jennifer Doudna于2012年8月在 Science 期刊发表了基因编辑史上的里程碑论文,成功解析了CRISPR-Cas9基因编辑的工作原理。而在几个月后的2013年2月,张锋在 Science 发表论文,首次将CRISPR-Cas9基因编辑技术改进并应用于哺乳动物和人类细胞。
CRISPR-Cas9基因编辑技术的出现,彻底改变了生物学,让基因编辑变得触手可及,让遗传疾病不再无药可医,也为癌症治疗带来巨大希望。它对科学的巨大推动价值已获得诺贝尔奖的肯定,此外,诞生十年时间里,围绕CRISPR基因编辑技术的上市公司就已超过10家,相关创业公司更是数不胜数。
CRISPR所带来的巨额经济回报,让双方展开了持续多年的专利战。
专利的核心争议在于,CVC团队率先解析了CRISPR-Cas9基因编辑的工作原理,但她们最初的论文并未提及CRISPR-Cas9可用于真核细胞,而真核细胞才是开发人类药物的关键。
2022年2月,美国专利商标局确定Broad研究所团队是第一个发明CRISPR-Cas9技术编辑人类细胞并用于制造药物的团队,因此拥有在真核细胞中使用CRISPR-Cas9基因编辑技术的专利。由于Editas Medicine获得了来自Broad研究所团队的独家授权,这意味着使用CRISPR-Cas9基因编辑技术的公司需要向Editas支付专利费以获取使用授权。
但双方的专利战并没有真正尘埃落定,在美国专利商标局做出决定后,CVC团队上诉到了美国联邦巡回上诉法院,据悉,联邦巡回上诉法院将在2024年年中之后做出裁决。
Editas躺赢
尽管CRISPR-Cas9专利的最终所有权仍然存在变数,但可以肯定的是,Editas立即从Vertex的付款中受益,该交易让Editas的现金流延长至2026年。据该公司第三季度的财务业绩, Editas此前的现金流足以支撑到2025年第三季度。
Editas的发言人表示,我们对公司的财务状况感到满意,预付款进一步扩大了现金流,确保了这项改变游戏规则的突破性技术能够惠及更多需要变革性药物的患者。
此次FDA不仅批准了Vertex和CRISPR公司开发的CRISPR基因编辑疗法Casgevy,同时也批准了蓝鸟生物的慢病毒基因疗法Lyfgenia,用于治疗镰状细胞病。
这也让Editas面临巨大压力,其开发的治疗镰状细胞病和β-地中海贫血的CRISPR基因疗法reni-cel(之前名为EDIT-301),还处于早期临床试验阶段。
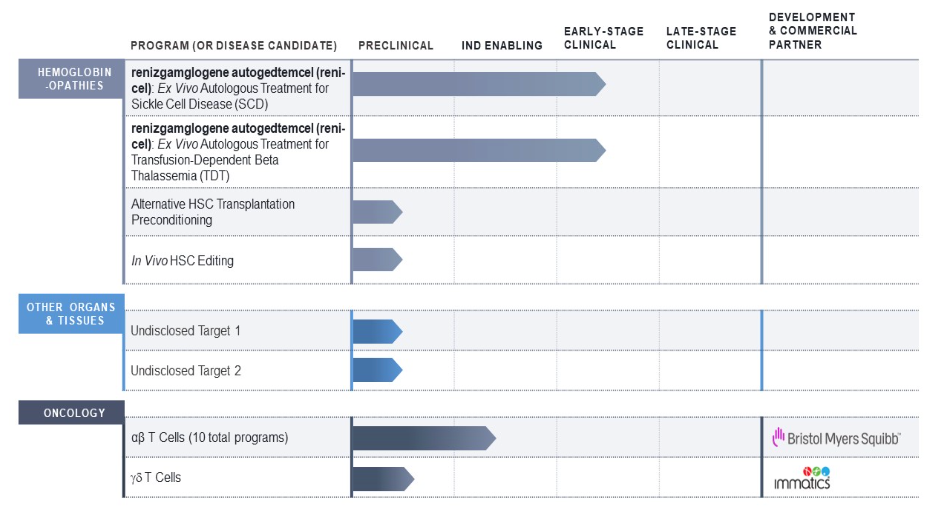
需要指出的是,Editas治疗镰状细胞病和β-地中海贫血的CRISPR基因疗法reni-cel,与已获批的Casgevy疗法主要有两点不同之处。一是所使用的基因编辑工具不同,二是治疗靶点不同。
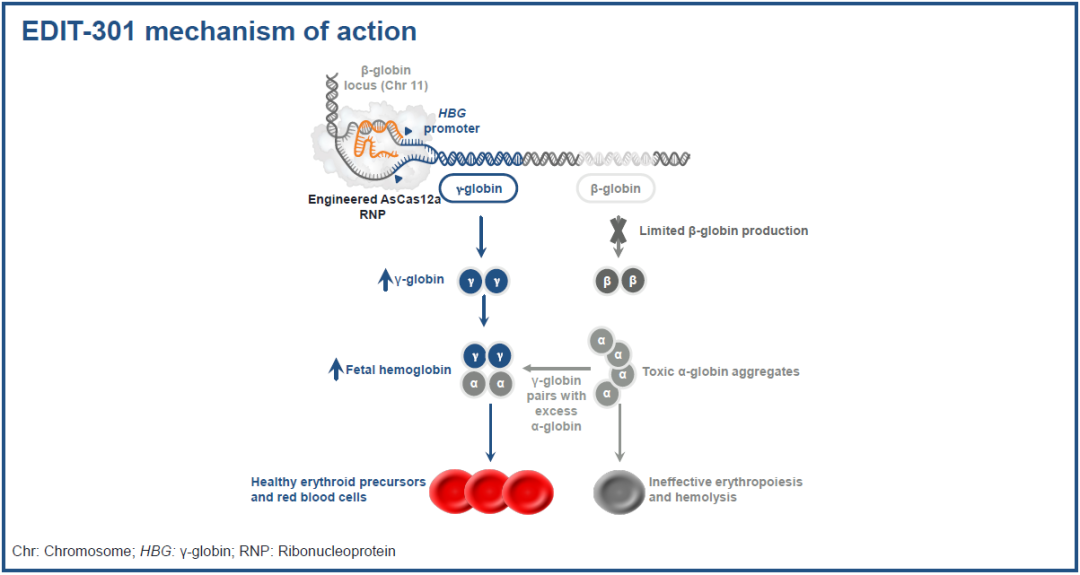
Editas的reni-cel疗法使用的并不是大家熟知的CRISPR-Cas9基因编辑系统,而是另一个由张锋开发的基因编辑系统——CRISPR-Cas12a。
具体来说,该基因编辑疗法使用CRISPR-Cas12a基因编辑技术对患者来源的CD34+造血干细胞和祖细胞进行基因编辑,编辑位点是表达HBG基因的启动子区域,这是因为HBG基因的启动子区域是转录抑制因子BCL11A的结合位点,靶向该位点就能抑制BCL11A,从而重新激活γ-珠蛋白的表达,改善患者的红细胞成熟。
治疗原理
之前的临床前研究显示,该疗法能够显著增加红细胞中的γ-珠蛋白水平和总血红蛋白水平,显著改善红细胞成熟并减少红细胞死亡,因此可作为一种有效的治疗选择。该疗法是在DNA层面的修改,可以实现一次治疗、终身有效。
Edita发布最新临床试验数据
此前,考虑到Casgevy的获批的可能性,Graphite Bio、Sangamo Therapeutics,以及诺华公司等纷纷暂停了在研的镰状细胞疗法。而Editas则是选择了在Reni-cel疗法上加倍下注,其在今年早些时候重新梳理了研究管线,向Reni-cel疗法投入了更多资金来加快临床试验进度。
2023年12月11日,Editas Medicine在第65届美国血液学会年会上分享了来自两个独立的1/2期临床试验的最新数据,报告了Reni-cel疗法治疗严重镰状细胞病或输血依赖性β-地中海贫血患者中的效果。
在11名严重镰状细胞病患者和6名输血依赖性β-地中海贫血患者中,Reni-cel疗法的安全性与白消安和自体造血干细胞移植的清髓性预处理一致,未报告与Reni-cel疗法相关的严重不良事件。
在治疗效果方面,接受Reni-cel治疗以来,所有11名严重镰状细胞病患者均无血管闭塞事件(VOE)发生。所有随访时间≥5个月的患者均保持正常血红蛋白水平和胎儿血红蛋白水平>40%。所有6名输血依赖性β-地中海贫血患者的总血红蛋白水平早期和稳健地增加,超过了需要输血的阈值9g/dL。
这些新的和有希望的数据表明,Reni-cel疗法是一种临床上差异化的、一次性的、持久的基因疗法,可以为镰状细胞病和β-地中海贫血患者提供改变生命的临床益处。Editas Medicine表示,将在2024年年中对更多患者逆行治疗,并分享进一步的临床结果。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


