新洞察!靶向HIF-2α或是一种有前景的乳腺癌化疗耐药治疗策略
来源:本站原创 2022-03-26 13:12
实体瘤微环境(TME)常以缺氧为特征,可促进乳腺癌细胞(BCS)向乳腺癌干细胞(BCSCs)转化。这种转化对乳腺癌具有治疗抵抗力,限制了临床治疗的益处。低氧诱导的转录因子,包括HIF-2α(也称为epas1),通过在低氧条件下激活多个转录程序,在调节肿瘤细胞干性方面发挥重要作用。
实体瘤微环境(TME)常以缺氧为特征,可促进乳腺癌细胞(BCS)向乳腺癌干细胞(BCSCs)转化。这种转化对乳腺癌具有治疗抵抗力,限制了临床治疗的益处。低氧诱导的转录因子,包括HIF-2α(也称为epas1),通过在低氧条件下激活多个转录程序,在调节肿瘤细胞干性方面发挥重要作用。
低氧肿瘤微环境(TME)在乳腺癌干细胞样表型的诱导和化疗耐药中起着关键作用。然而,低氧TME对乳腺癌细胞(BCS)进行干性重编程的机制仍然很大程度上是未知的。
图片来源: https://doi.org/10.1038/s41418-022-00963-8
近日,中国医科大学的研究者在Cell Death &
Differentiation杂志上发表了题为“A novel HIF-2α targeted
inhibitor suppresses hypoxia-induced breast cancer stemness via
SOD2-mtROS-PDI/GPR78-UPRER axis”的研究性文章,该研究报道了HIF-2-αSOD2-mtROS-PDI/GRP78-UPRER轴在介导缺氧诱导的BCS干化中的关键作用,强调了细胞器之间的相互作用,并为进一步开发靶向HIF-2α抑制剂作为一种有前景的化疗耐药乳腺癌的治疗策略提供了证据。
在本研究中,研究者首先发现低氧诱导因子-2α激活药物敏感的乳腺癌细胞系MCF7和T47D细胞的内质网未折叠蛋白反应(UPRER),诱导耐药干细胞型。在体内外,缺氧诱导因子-2α的基因缺失或药物抑制(YQ-0629)可消除低氧诱导的干细胞样表型。
机制上,缺氧诱导因子-2α可激活缺氧状态下超氧化物歧化酶2的转录,从而降低线粒体ROS(mtROS)水平。随着mtROS转运到内质网的减少,蛋白质二硫键异构酶(PDI)的表达和活性受到抑制,使葡萄糖调节蛋白78(GRP78)从UPRER的受体蛋白中解离出来,结合错误折叠的蛋白激活UPRER,最终赋予BCS化疗耐药性和干细胞样特性。
此外,mtROS清除剂mitoTEMPOL、16F16(PDI抑制剂)或GRP78过表达可显著逆转HIF-2α基因敲除引起的线粒体ROS和PDI水平的增加以及随后的UPRER抑制。
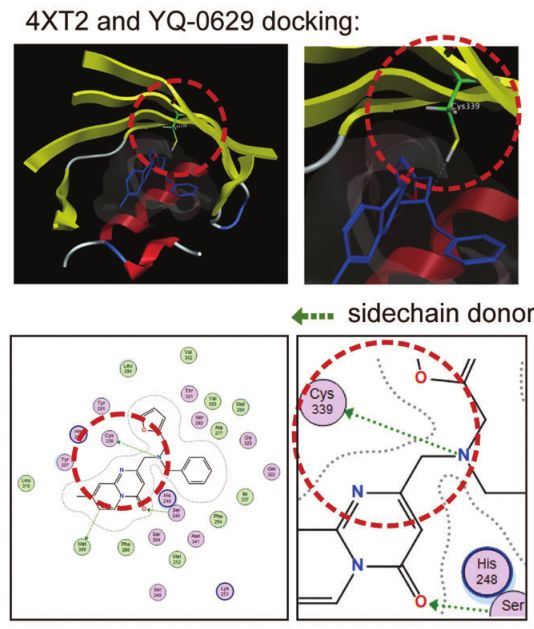
YQ-0629靶向HIF-2α抑制BCSCs的干细胞特性
图片来源:
https://doi.org/10.1038/s41418-022-00963-8
综上所述,研究者阐明了HIF-2α重塑了乳腺癌的干性,并通过SOD2-mtROS-PDI/GRP78-UPRER轴实现了对BCS的化疗耐药。研究者还开发了一种新型的HIF-2α靶向抑制剂YQ-0629,它与PTX在体内外具有协同抑制肿瘤生长的作用,是一种有希望用于乳腺癌靶向治疗的小分子化合物。(生物谷 Bioon. com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



