PNAS:让小胶质细胞积极干掉Aβ,这个蛋白是关键!
来源:奇点糕 2023-04-14 11:40
这项研究发现了TSPO对于小胶质细胞吞噬功能的重要性,阐明其促进小胶质细胞的吞噬依赖于促进线粒体的有氧呼吸。同时还发现了HK移位至线粒体会导致小胶质细胞吞噬能力受损,并且这一效应并不依赖于其促进糖酵解
阿尔茨海默病(AD)是威胁人类健康的“头”等大病,AD的典型病理特征包括Aβ蛋白沉淀斑块以及Tau蛋白过度磷酸化导致的神经纤维缠结。小胶质细胞可以吞噬Aβ沉淀,发挥抑制AD进展的作用。吞噬Aβ是一个“体力活”,在此过程中小胶质细胞需要很多能量。而有研究发现,AD患者的小胶质细胞出现了代谢紊乱[1]。
线粒体转位蛋白(TSPO)是一种可以被正电子断层扫描观察到的炎症标志物,它在AD患者小胶质细胞中显著上调[2],有研究表明靶向TSPO可以减轻AD[3,4],但是TSPO在小胶质细胞免疫反应和AD发病机制中的作用尚不清楚。
近期,由新加坡南洋科技大学Anna M. Barron教授领衔的研究团队在《美国国家科学院院刊》(PNAS)上发表研究成果[5],他们发现TSPO的缺失会增加己糖激酶2(HK2)与线粒体的结合,从而使小胶质细胞的糖代谢由有氧呼吸转变为糖酵解,并损害了小胶质细胞的吞噬能力。抑制HK2结合至线粒体能够增强小胶质细胞的吞噬能力。
这项研究证明了TSPO及其线粒体复合物HK2在调控小胶质细胞代谢以及吞噬功能方面的作用,并提示靶向线粒体HK2可能是一种潜在的AD疗法。

为了确定TSPO对神经炎症的影响,研究团队对LPS刺激前后的海马区进行了RNA测序。结果显示,在未刺激时,野生型(WT)以及TSPO敲除(TSPO-KO)小鼠海马区差异表达基因数量极少,而在脂多糖(LPS)刺激后,差异表达基因增加795个,这支持TSPO在神经炎症中发挥调节作用的观点。基因富集分析发现TSPO-KO小鼠免疫以及炎症相关通路基因表达下降,其中最明显的是吞噬通路相关基因。
接下来研究团队识别出了124个TSPO相互作用蛋白,其中有44个在线粒体中富集,大部分相互作用蛋白富集在代谢以及免疫反应通路中。
这些数据提示TSPO可能在大脑的炎症中发挥调节作用,并且其机制可能涉及代谢。
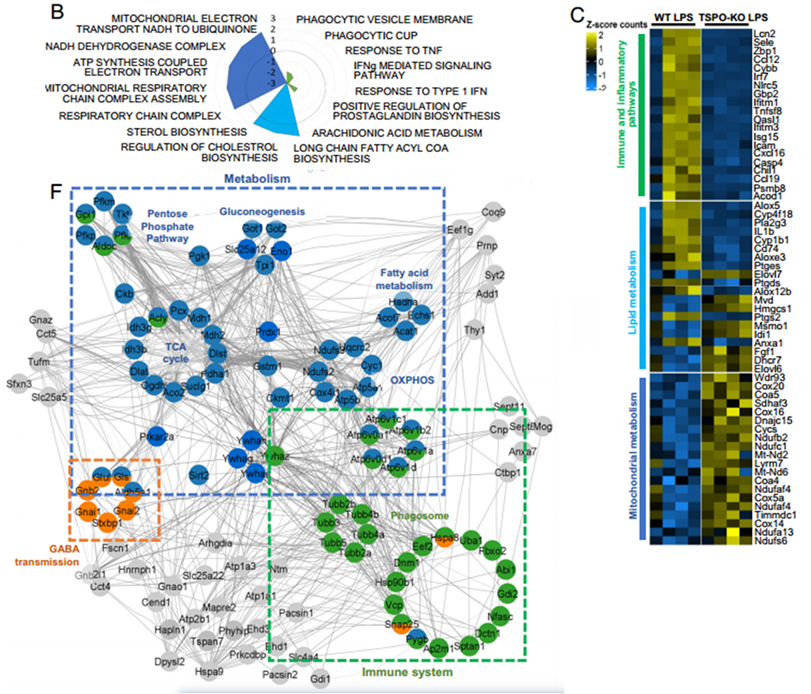
TSPO缺失改变神经炎症中的免疫和代谢
由于上述的转录组学和蛋白质组学数据表明TSPO涉及代谢途径和免疫功能,因此研究团队在原代小鼠小胶质细胞中检测敲除TSPO对细胞能量代谢的影响,结果显示,敲除TSPO后小胶质细胞的有氧呼吸能力显著下降,线粒体膜电位降低,由线粒体产生的ATP减少。这些数据表明TSPO在小胶质细胞有氧呼吸产能中有重要的作用。
TSPO-KO小胶质细胞有氧呼吸能力受损的同时,糖酵解的限速酶HK的表达显著上调。已有的研究表明,HK可以结合至TSPO复合物电压门控阴离子通道(VDAC)上,从而增强其酶活性,进而促进糖酵解[6]。与此一致的是,TSPO-KO小胶质细胞中与线粒体结合的HK显著增加,而且TSPO-KO小胶质细胞糖酵解活性增强。这表明,敲除TSPO损伤小胶质细胞的有氧呼吸能力,增强了糖酵解。
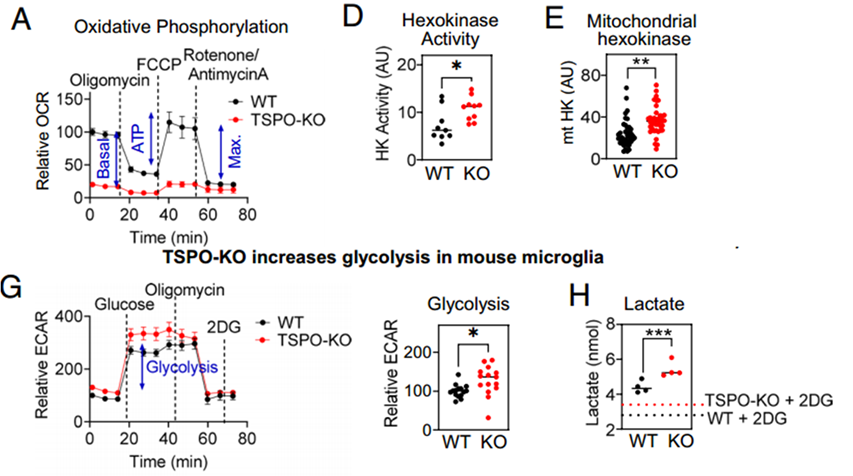
TSPO-KO小胶质细胞有氧呼吸受损,糖酵解增强
由于吞噬Aβ是一个十分消耗能量的过程,而敲除TSPO会降低小胶质细胞有氧呼吸能力,因此研究团队想知道敲除TSPO是否会抑制小胶质细胞吞噬Aβ的能力。实验结果显示,TSPO-KO小胶质细胞吞噬Aβ的能力显著低于WT小胶质细胞,同时TSPO激动剂可以增强WT小胶质细胞吞噬Aβ的能力却无法增强TSPO-KO小胶质细胞吞噬Aβ的能力。这表明,敲除TSPO会损伤小胶质细胞吞噬Aβ的能力。
为了验证上述发现在小鼠体内是否同样存在,研究团队分析了AD小鼠大脑中小胶质细胞TSPO的表达水平,结果显示Aβ+的小胶质细胞(代表吞噬Aβ能力强)比Aβ-小胶质细胞TSPO表达水平更高。更进一步地,敲除了TSPO的AD小鼠大脑中Aβ+小胶质细胞比例降低,并且Aβ沉淀显著增加。这些数据提示,TSPO对小胶质细胞吞噬清除Aβ有重要作用。
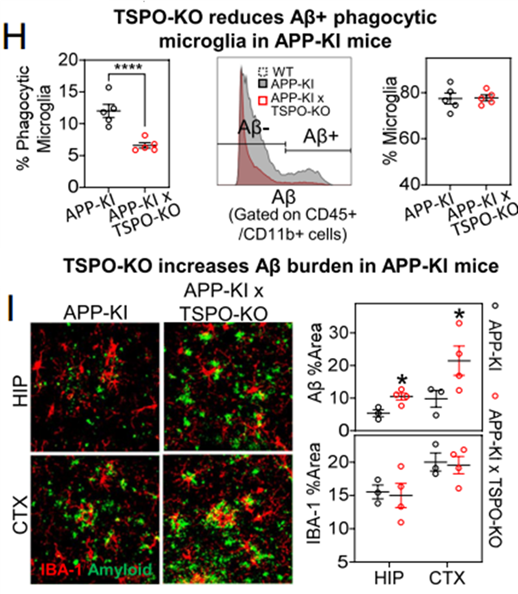
敲除TSPO损害小胶质细胞吞噬Aβ的能力并增加Aβ沉淀
上述发现已经证明敲除TSPO损害小胶质细胞有氧呼吸能力,增强糖酵解,损害小胶质细胞吞噬Aβ的能力。研究团队猜想,线粒体上HK的过度聚集驱动糖酵解,这可能促进了吞噬能力的受损。因此,他们使用一种可以透过细胞膜进入细胞的、无酶活性的HK多肽片段(HKp)处理TSPO-KO小胶质细胞,HKp可以与HK竞争性结合至线粒体。
他们发现,HKp处理后,TSPO-KO小胶质细胞的糖酵解水平下降,这也证明了TSPO-KO小胶质细胞的糖酵解水平升高是由于HK结合至线粒体引起的。
接下来研究团队设计了一种由蓝光控制二聚化的HKp——HKp-sspb-RFP,在没有蓝光照射情况下,它们可以与HK竞争性结合至线粒体,在蓝光照射下,这些多肽从线粒体上脱落,这样就能够控制HK的定位。实验结果显示,在没有光照的情况下,TSPO-KO小胶质细胞的吞噬能力比光照情况下高50%。这说明在TSPO-KO小胶质细胞中,HK在线粒体上的聚集损伤小胶质细胞的吞噬能力。
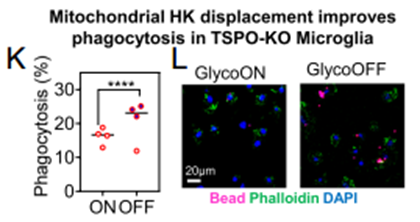
抑制HK结合至线粒体增强小胶质细胞的吞噬能力
以上的结果表明TSPO-KO小胶质细胞中HK结合至线粒体促进糖酵解,并损伤小胶质细胞的吞噬功能,那么HK结合至线粒体促进糖酵解与损伤吞噬功能是相互关联的吗?
研究团队构建了几种不同的HK表达载体:tHK(无法结合至线粒体)、mHK(可以结合至线粒体,但没有代谢酶活性)、FL-HK(全长WT HK)。检测表达这几种HK的小胶质细胞的吞噬能力,结果显示,表达tHK的小胶质细胞吞噬能力显著强于表达FL-HK以及mHK的小胶质细胞,而表达mHK与FL-HK的小胶质细胞吞噬能力没有差异,这表明HK结合至线粒体抑制吞噬不依赖于其促进糖酵解的能力。
此外,研究团队发现,Aβ能够促进HK结合至线粒体,这表明Aβ或许可以通过影响HK的定位抑制小胶质细胞的吞噬能力。
总的来说,这项研究发现了TSPO对于小胶质细胞吞噬功能的重要性,阐明其促进小胶质细胞的吞噬依赖于促进线粒体的有氧呼吸。同时还发现了HK移位至线粒体会导致小胶质细胞吞噬能力受损,并且这一效应并不依赖于其促进糖酵解的能力。这项研究成果不仅解释了为何靶向TSPO可以减少Aβ的积累和神经元死亡,同时也提示我们,抑制HK结合至线粒体或许是一个治疗AD的有效策略。
参考文献:
1. E. C. B. Johnson et al, Large-scale proteomic analysis of Alzheimer’s disease brain and cerebrospinal fluid reveals early changes in energy metabolism associated with microglia and astrocyte activation.Nat. Med. 26, 769–780 (2020).
2. L. Zhang et al, Recent developments on PET radiotracers for TSPO and their applications in neuroimaging. Acta Pharm. Sin. B 11, 373–393 (2021).
3. A. M. Barron et al, Ligand for translocator protein reverses pathology in a mouse model of Alzheimer’s disease. J. Neurosci. 33, 8891–8897 (2013).
4. L. H. Fairley et al, Neuroprotective effect of mitochondrial translocator protein ligand in a mouse model of tauopathy. J. Neuroinflammation 18, 76 (2021).
5. Fairley LH, Lai KO, Wong JH, et al. Mitochondrial control of microglial phagocytosis by the translocator protein and hexokinase 2 in Alzheimer's disease. Proc Natl Acad Sci U S A. 2023;120(8):e2209177120. doi:10.1073/pnas.2209177120.
6. M. Colombini, VDAC: The channel at the interface between mitochondria and the cytosol. Mol. Cell Biochem. 256, 107–115 (2004).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


