新抗原:癌症免疫治疗的新希望
来源:医药速览 2023-01-20 14:19
新抗原的免疫疗法仅在少数有据可查的患者反应中显示出客观疗效。仍需要进行多种改进来改善其疗效,包括提高新抗原预测的准确性,克服免疫逃避,优化生产过程和有效招募患者。

此外,在RNA-seq中还可以发现更多隐藏的生物信息,如拷贝数变化、微生物污染、可转座元件、细胞类型以及新抗原的存在等信息。RNA-seq也可用于检测可变剪接事件,并估计突变等位基因表达的相对频率。通过使用像配对测序这样可以检测染色体重排的方法,基于NGS的TMB检测的预测值可能会大大提高。为了完全识别移码突变和异常亚型引起的新抗原,需要使用Oxford Nanopore Technologies的纳米孔型测序仪MinION进行全长转录组测序,这一技术的准确率约为90%,为目前的RNA-seq提供了识别等位基因特异性转录和剪接的补充信息。免疫肽组学技术使附着在MHC上的肽的高通量鉴定成为可能,该技术使用MS直接检查免疫沉淀和提取的MHC结合肽。除了验证异常DNA序列或RNA表达产生的新抗原外,基于MS的蛋白质组学还为蛋白质水平的新抗原检测提供了“金标准”。此外,MS还与NGS整合,以进一步检测由体细胞突变,非编码RNA和蛋白酶体剪接产生的肿瘤特异性新抗原
计算机预测新抗原
基于NGS数据,可以利用计算机模拟方法创建虚拟多肽,并发现潜在的新抗原。简而言之,新抗原预测的工作流程可归纳为以下步骤:1)突变识别;2)HLA分型;3)基于HLA结合亲和力的新抗原筛选和优先排序;4)使用基于T细胞的检测方法对免疫原性新抗原进行实验验证。
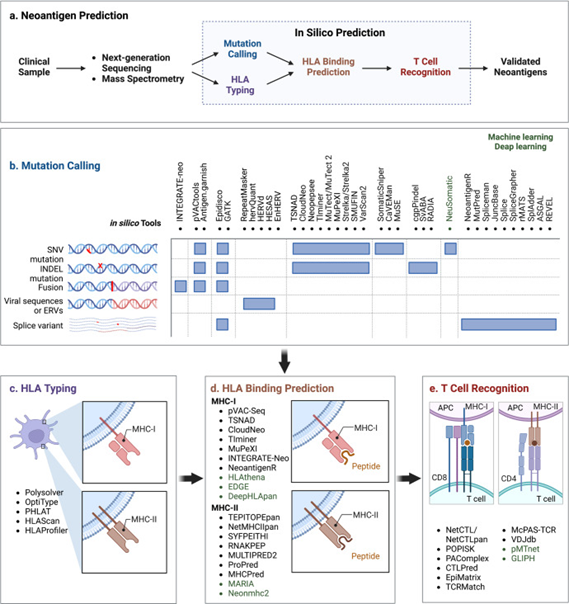
图2:新抗原预测的工作流程
候选新抗原免疫原性的评估和验证
在评估潜在新抗原的免疫原性时,考虑pMHC复合物的TCR识别至关重要。计算机技术中预测新抗原特异性T细胞识别最常用的方法是NetCTL / NetCTLpan,它通过结合MHC结合,C端切割亲和力和TAP转运来生成复合评分,而不是直接预测T细胞结合。除了鉴定TCR-pMHC配对外,聚类方法(如pMTnet和GLIPH)还可以聚类识别相同表位并预测其HLA限制的TCR。
新抗原对T细胞的反应性主要通过基于T细胞的检测、多色标记的MHC四聚体、酶联免疫吸附斑点(ELISpot)和T细胞谱分析进行验证或筛选。T细胞免疫原性检测是评价候选新抗原免疫原性最直接的方法。肽刺激后,通过流式细胞术测量 T 细胞活化标志物 4-1BB 和 OX-40 以及 ELISpot 测定中的 IFN 产生来测量体外扩增的新抗原特异性 T 细胞反应性。多色标记的MHC四聚体是利用DNA条形码、镧系元素编码或肽的荧光色素编码,评估T细胞对多种潜在表位的反应性,具有高度敏感且所需材料最少的优势;将单细胞RNA测序(scRNA-seq)与TCR测序相结合可以提高检测的灵敏度;基于WES指导的新抗原预测和短期肽刺激的T细胞培养物的TCR测序,特异性T细胞突变相关新抗原功能扩增(MANAFEST)试验可灵敏地表征新抗原特异性TCR Vβ克隆型。MANAFEST检测与所有HLA单倍型兼容,并可追踪福尔马林固定石蜡包埋(FFPE)和/或冷冻组织中的新抗原特异性T细胞。除了评估TCR Vβ克隆型的肿瘤特异性外,MANAFEST还可以研究新抗原特异性T细胞应答随时间推移的动态变化,并利用治疗前或治疗后获得的液体活检监测免疫治疗的疗效。此外还有Trogocytososis、T-Scan等新开发的方法用于新抗原的免疫原性。
基于新抗原的治疗策略
基于其肿瘤特异性和免疫遗传学的优势,新抗原可以作为癌症免疫疗法的新兴靶标,包括肿瘤疫苗、青蒿素综合疗法和基于抗体的疗法,以及免疫检查点阻断疗法的潜在预测因子。新抗原由专门针对每个患者发现的个体化新抗原或在许多患者癌症中表达的共享新抗原组成。由于个性化新抗原是患者特异性的,因此不能用于靶向大量患者。与个体化新抗原疗法相比,基于共享新抗原的现成疗法可以节约资源和时间。
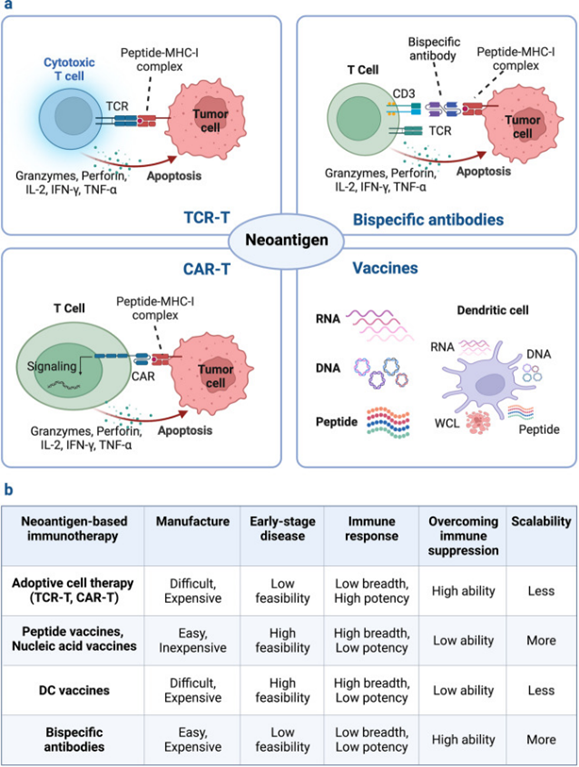
图3:基于新抗原的疗法的分类
基于新抗原的治疗性疫苗
新抗原疫苗是激发、增强和多样化抗肿瘤T细胞应答的有效手段,具有可行性高、总体安全性高、制备简单等优点。以新抗原为基础的多肽、核酸、树突状细胞等多种形式的疫苗正在不同类型肿瘤患者的临床试验中进行评估。目前多肽和核酸疫苗主要靶向来自体细胞突变的预测新抗原,包括SNVs、移码INDELs和基因融合。DC疫苗既可以通过脉冲合成肽或核酸靶向选定的新抗原,也可以通过引入全细胞裂解物(WCL)靶向整个TSA。
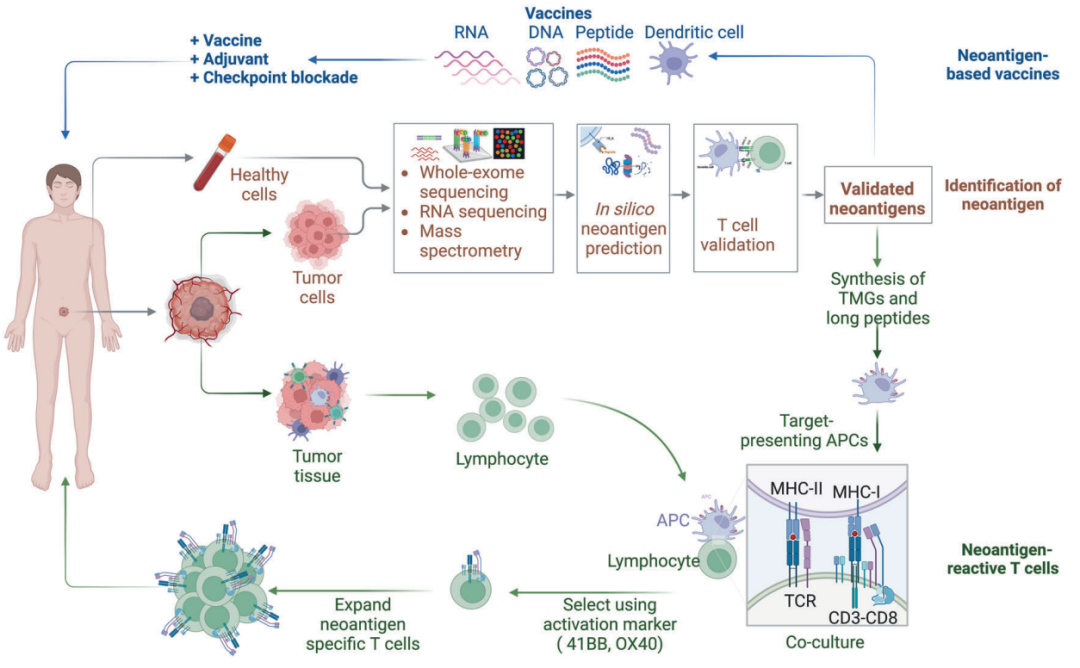
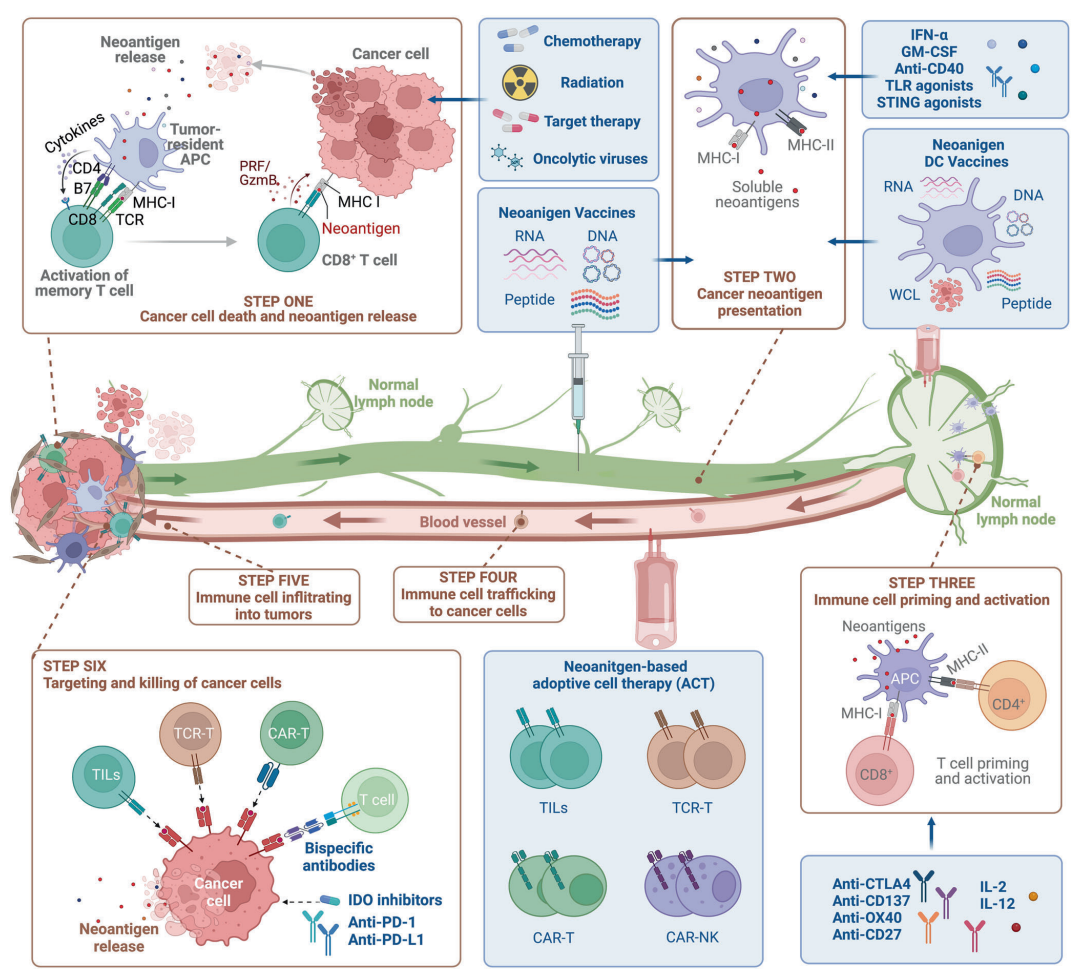
图4:基于新抗原的癌症免疫疗法的生产示意图
目前,新抗原的免疫疗法仅在少数有据可查的患者反应中显示出客观疗效。仍需要进行多种改进来改善其疗效,包括提高新抗原预测的准确性,克服免疫逃避,优化生产过程和有效招募患者。总体而言,新抗原在癌症免疫疗法中起着举足轻重的作用,拓宽了肿瘤治疗思路,具有广阔的发展前景。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


