清华大学最新Cell论文:揭开大脑中的“恋爱开关”
来源:生物世界 2025-05-23 10:33
这项研究首次发现大脑的前额叶皮层中存在一个受激素动态调控的“恋爱开关”,并揭示了其调控机制,阐明了 Cacna1h+ 神经元如何整合个体的内在激素状态与外部社交信息。
卵巢激素的波动精密调控女性内在生理状态,并显著影响其性别特异的社交行为与情绪反应,这是导致精神疾病易感性存在性别差异的重要因素。在不同物种中,雌性对雄性的社交偏好与性接受度均与动情周期(尤其是排卵期)同步,从而最大程度提高繁殖成功率。
这表明了雌性的大脑会将与性相关的社交信号整合至其生殖状态中,进而引导适应性社会-性互动行为(例如主动接近、探索、回避或对雄性的性接受)。内侧前额叶皮层(mPFC)作为社交大脑网络的核心节点,mPFC 可能通过整合内外社交情境信息并调控固有的皮层下神经环路,在社交大脑网络中发挥自上而下的协调作用,从而引导适应性社交行为。然而,mPFC 神经元如何编码自身动情状态,并通过整合外部社交线索与内部动情状态来适应性调节雌性的社交性行为,目前仍不清楚。
2025 年 5 月 20 日,清华大学生命科学学院李坤团队与洛克菲勒大学 Nathaniel Heintz 团队合作(王玉平、宋鑫莉、陈详茂、周颖、马冀豪、张芳、韦理强为论文共同第一作者),在国际顶尖学术期刊 Cell 上发表题为:Integrating reproductive states and social cues in the control of sociosexual behaviors 的研究论文。
该研究在大脑内侧前额叶皮层(mPFC)中鉴定出一类特异表达 Cacna1h 的神经元群体,作为调控“恋爱兴趣”的关键神经单元,能够混合编码个体激素状态与社交对象的性别信息,并以性别相反的方式调控异性社交兴趣与性行为。
该研究构建了一个两性差异的前额叶-下丘脑调控模型,首次揭示了激素状态与社交信息在大脑皮层水平的整合机制,发现本能性社交行为的灵活适应性依赖于前额叶皮层的自上而下精细调控,为深入理解与性别相关的异性社交障碍提供了理论基础和潜在干预靶点。

雌性的社交性行为对于生存和繁衍至关重要,这种行为受到卵巢激素的调节,并在适当的社交暗示情境下被激发。
前额叶中的“社交雷达”
在这项最新研究中,研究团队通过单细胞测序技术,在大脑决策中枢——内侧前额叶皮层(mPFC)中锁定了一群表达 Cacna1h 基因的神经元。这些神经元如同自带“生理周期监测仪”和“性别识别器”,展现三大神奇特性:
1、周期感应器:在雌性动情期,卵巢激素通过雌激素受体直接激活 Cacna1h 基因,使神经元产生更多 T 型钙通道;
2、性别识别仪:显微成像显示,当雌鼠处于动情期时,这些 Cacna1h+ 神经元对雄性气味产生强烈反应;而雄性个体的同类神经元却对雌性信号产生抑制;
3、行为开关:激活动情期雌鼠的 Cacna1h+ 神经元,能让其表现出持续求偶行为,抑制则导致"性冷淡";而在雄性中,效果完全相反。
激素如何改写神经元密码
研究团队进一步揭示了背后的分子机制:
卵巢激素(例如雌激素/孕酮)直接结合 Cacna1h 基因的启动子,从而驱动了 Cacna1h 基因在动情期达到表达峰值。当雌性进入动情期时,Cacna1h 基因编码的 T 型钙通道 Cav3.2 在 mPFC 中的 Cacna1h+ 神经元中大量表达。当雌性与雄性互动时,大脑释放的“爱的激素”(催产素)会向这群神经元发出抑制性信号,这种特殊的低阈值 T 型钙通道在超极化后触发强烈的反弹兴奋(rebound excitation)活动。这就像给神经元安装了扩音器,即便是微弱的异性线索也能被迅速放大,并引发显著的电活动,从而增强该群神经元对雄性信息的响应,并激活下游前下丘脑(AHN)环路,驱动动情期雌性对异性产生强烈的“恋爱兴趣”。而在动情期特异性敲除 mPFC 神经元中的 Cacna1h 基因,则会使“恋爱兴趣”显著平息。
雌雄大脑的“镜像调控”
令人震惊的是,这同一群神经元,在雌雄个体中发挥了完全相反的作用——雌性 mPFC 中的 Cacna1h+ 神经元促进对异性的兴趣,而雄性 mPFC 中的 Cacna1h+ 神经元则抑制对异性的兴趣。
mPFC 中的 Cacna1h+ 神经元主要感知雌性信息,但因 Cacna1h 表达水平较低,无法诱发 T 型钙通道 Cav3.2 介导的反弹兴奋电流,从而使该神经元群体在异性的刺激下表现为抑制性反应。
从进化角度来看,这种“抑制调控”机制可能限制了雄性的过度求偶行为,从而平衡能量与繁殖策略。
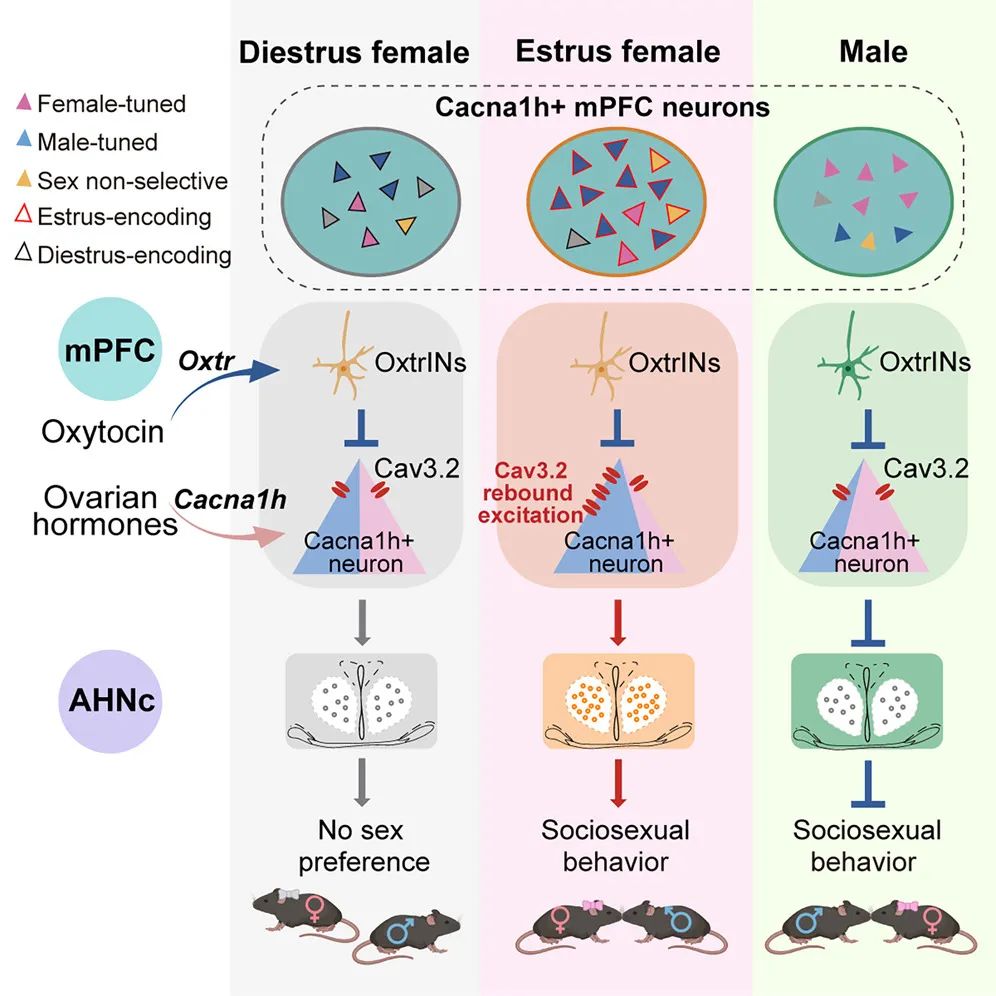
总的来说,这项研究首次发现大脑的前额叶皮层中存在一个受激素动态调控的“恋爱开关”,并揭示了其调控机制,阐明了 Cacna1h+ 神经元如何整合个体的内在激素状态与外部社交信息,精准调控对异性的社交兴趣和行为表现,并具有显著的性别与状态依赖性。
从临床角度来看,Cacna1h+ 神经元及其依赖的 T 型钙通道 Cav3.2 功能障碍可能构成雄性性欲亢进与雌性性欲减退的生物学基础,这也解释了为何临床上常见女性性冷淡和男性性欲亢进。此外,性功能障碍与抑郁、焦虑等精神疾病的高度共病,且呈现显著的性别差异,因此,该研究为理解和干预异性社交动机相关障碍提供了全新的性别特异性作用靶点和治疗策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


