Nature:线粒体转移,癌细胞免疫逃逸的秘密武器?
来源:生物探索 2025-01-26 11:50
通过对多种癌症类型的临床样本进行分析,首次揭示了癌细胞通过线粒体(mtDNA)转移实现免疫逃逸的全新机制。
Nature的研究报道“Immune evasion through mitochondrial transfer in the tumour microenvironment”,通过对多种癌症类型的临床样本进行分析,首次揭示了癌细胞通过线粒体(mtDNA)转移实现免疫逃逸的全新机制。研究发现,癌细胞能够将携带线粒体DNA突变的线粒体转移至T细胞。这些突变线粒体不仅不会被T细胞的线粒体自噬系统清除,反而会通过特定分子保护机制稳定存在,从而导致T细胞的代谢异常和功能失效。具体而言,这种线粒体转移会使T细胞进入衰老状态,影响其效应功能和记忆形成能力,从而严重削弱抗肿瘤免疫反应。
研究进一步指出,携带mtDNA突变的肿瘤组织在使用免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)治疗时表现出较差的疗效。这一发现为我们理解癌症免疫治疗失败的潜在原因提供了重要线索,并为未来开发更有效的癌症免疫治疗策略指明了新方向。

免疫系统的挑战
免疫系统是人体防御机制中的重要组成部分,能够识别和清除外来病原体和异常细胞。然而,在癌症的发展过程中,免疫系统面临着一场艰难的“攻防战”。尽管免疫细胞,尤其是T细胞(T cells),在抗肿瘤免疫中扮演着关键角色,癌细胞却利用多种策略巧妙地逃避了免疫系统的监视和攻击。
免疫系统与癌症的“拔河战”
T细胞的主要任务是通过识别肿瘤细胞表面的特异性抗原来触发攻击。然而,癌细胞会通过调节肿瘤微环境(tumor microenvironment, TME),削弱T细胞的攻击能力。例如,癌细胞能够分泌免疫抑制性分子,如程序性死亡配体1(PD-L1),与T细胞表面的程序性死亡蛋白1(PD-1)结合,从而抑制T细胞的活性。这种“免疫刹车”机制不仅减弱了T细胞的杀伤能力,还促使它们逐渐进入衰竭状态,丧失持久的抗肿瘤作用。
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)通过解除这一“免疫刹车”机制,显著提高了多种癌症的治疗效果。然而,研究表明,许多患者对ICI疗法反应不佳,这与癌细胞更深层次的免疫逃逸机制密切相关。理解这些机制是进一步提升治疗效果的关键。
肿瘤微环境中的免疫压制
TME是由癌细胞、基质细胞、免疫细胞及其分泌的分子共同构成的复杂生态系统。在TME中,癌细胞通过调节局部代谢环境削弱免疫反应。例如,TME通常表现出低氧(hypoxia)和低葡萄糖浓度的特性,迫使免疫细胞转向低效的糖酵解代谢(glycolysis),从而降低其效能。此外,癌细胞的代谢重编程还会释放活性氧(reactive oxygen species, ROS),进一步损伤浸润肿瘤的淋巴细胞(TILs),使其进入终末分化和功能衰竭状态。
线粒体转移:癌细胞的新型“武器”
线粒体(mitochondria)被誉为细胞的“能量工厂”,是大多数真核细胞中至关重要的细胞器。它通过氧化磷酸化(oxidative phosphorylation, OXPHOS)将营养物质转化为能量分子ATP,为细胞活动提供动力。此外,线粒体还参与调节细胞内钙稳态、活性氧(ROS)平衡以及细胞凋亡等多种重要功能。在免疫细胞,尤其是T细胞中,线粒体功能的健全对于维持其代谢活动、效应功能及免疫记忆的形成至关重要。
在肿瘤微环境(tumor microenvironment, TME)中,T细胞常常因能量供应不足和代谢压力而表现出功能失效。然而,癌细胞不仅仅依靠代谢抑制削弱T细胞,还通过更隐秘的机制——线粒体转移,直接影响T细胞的核心代谢和功能。
癌细胞如何利用线粒体转移
该研究首次揭示了一种新型免疫逃逸机制,即癌细胞能够将自身的线粒体转移到T细胞中,从而通过直接干扰T细胞的能量代谢和功能来削弱其免疫活性。这种线粒体转移并非随机事件,而是一个受调控的过程,涉及癌细胞通过细胞间物质传递网络(如纳米管、外泌体等)与T细胞进行物理和分子连接。
值得注意的是,癌细胞转移的线粒体往往携带线粒体DNA(mtDNA)突变。这些突变显著影响了线粒体的功能,例如降低ATP的生成效率并增加ROS的产生。这些功能异常的线粒体在T细胞中稳定存在,破坏了其正常的代谢平衡,迫使T细胞进入糖酵解依赖状态。这不仅削弱了T细胞的抗肿瘤杀伤力,还导致其快速进入功能衰竭和衰老状态。
实验数据显示,在多种癌症类型的患者肿瘤组织中,携带mtDNA突变的线粒体在T细胞内的积累显著增加。对比健康个体和肿瘤患者的T细胞代谢情况,研究发现,肿瘤浸润T细胞的氧化磷酸化活性明显降低,而糖酵解代谢的标志物显著升高。此外,转移到T细胞中的线粒体还改变了T细胞线粒体的形态,表现为嵴结构的破坏和线粒体膜电位的紊乱,这些变化直接影响了T细胞的效应功能和免疫记忆形成。
通过线粒体转移,癌细胞不仅实现了对T细胞功能的精确抑制,还为其免疫逃逸增加了一道屏障。该研究进一步指出,这种机制与免疫治疗效果不佳密切相关,尤其是在携带大量mtDNA突变的患者中,免疫检查点抑制剂的疗效显著降低。
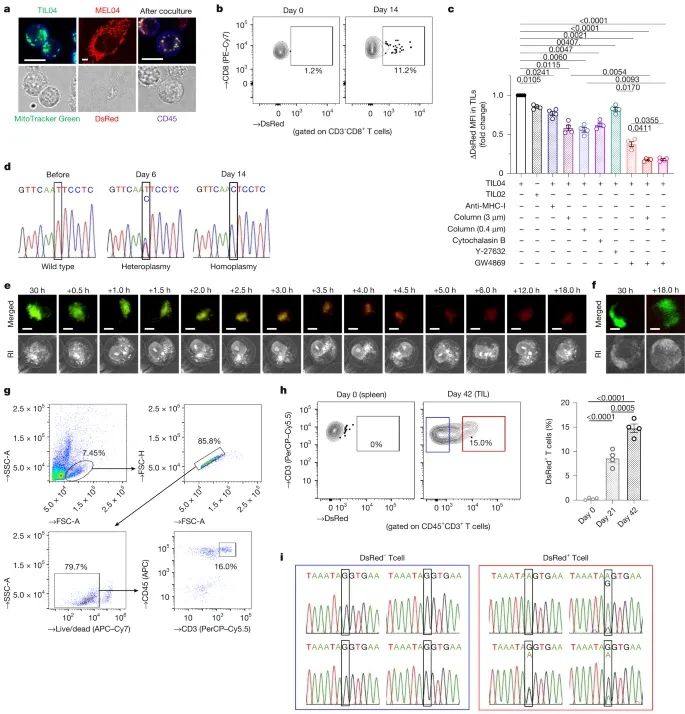
癌细胞线粒体DNA突变(mtDNA-mutated mitochondria)通过多种机制转移至肿瘤浸润淋巴细胞(TILs)并逐渐在TILs中达到同质性(Credit: Nature)
线粒体转移的可视化证据(图a, e, f)
使用共聚焦显微镜和数字全息显微镜,观察到标记为MitoTracker Green的TIL04#9细胞与标记为MitoDsRed的MEL04癌细胞共培养时,癌细胞线粒体成功转移至TILs。共培养2天后,可以清晰地观察到MEL04细胞的线粒体出现在TIL04#9细胞中。时间序列影像分析显示,线粒体的转移和整合是一个动态的过程,TILs逐渐吸收和整合来自癌细胞的线粒体。
线粒体转移的流式细胞术分析(图b, g, h)
流式细胞术分析进一步证实,标记为DsRed的癌细胞线粒体能够有效转移至TILs。在体内实验中,对肿瘤组织进行消化并用CD45和CD3标记淋巴细胞,发现DsRed+的T细胞比例显著增加,证明癌细胞线粒体能够在体内转移至TILs。
线粒体转移机制的研究(图c)
为研究线粒体转移的机制,实验通过抑制主要组织相容性复合物I类(MHC-I)、抑制细胞间纳米管(TNT, 使用细胞松弛素B)、插入阻隔膜(3μm或0.4μm孔径)、抑制小型胞外囊泡(EV, 使用GW4869)或抑制微型胞外囊泡(microEV, 使用Y-27632)等方法,对转移过程进行干预。结果表明,抑制TNT和小型EV显著减少了癌细胞线粒体向TIL的转移,说明这些路径是主要的转移机制。
转移线粒体的mtDNA同质性变化(图d, i)
对共培养后的TILs进行单细胞分选和mtDNA测序,发现转移的mtDNA逐渐在TILs中达到同质性(homoplasmy),表明癌细胞线粒体在TILs内被稳定整合。体内实验也证实,DsRed+ T细胞中的mtDNA与癌细胞的mtDNA一致,而DsRed− T细胞中未检测到癌细胞来源的mtDNA。
线粒体DNA突变的“暗藏杀机”
线粒体DNA(mtDNA)是动物细胞中唯一存在于细胞核外的遗传物质,它由一小段环状双链DNA组成,编码着与能量代谢密切相关的核心蛋白。由于缺乏高效的DNA修复机制,mtDNA极易受到外界刺激如活性氧(ROS)的损伤,从而产生突变。研究发现,癌细胞的mtDNA突变具有以下显著特点:
高频突变:癌细胞的mtDNA突变频率远高于正常细胞。该研究数据显示,约80%的肿瘤样本中检测到了特定的mtDNA突变,且这些突变多集中在与氧化磷酸化(oxidative phosphorylation, OXPHOS)相关的基因区域。
功能性突变:这些突变不仅是“旁观者”,还直接影响了线粒体的核心功能,例如ATP生成的效率降低、呼吸链复合物活性受损,以及ROS生成增加。
选择性富集:某些mtDNA突变在癌细胞中被选择性富集,可能赋予其生存优势,例如通过改变代谢途径以适应肿瘤微环境中的低氧和营养匮乏条件。
线粒体DNA突变对T细胞的“暗杀”机制
癌细胞的mtDNA突变不仅是其代谢重编程的一部分,还通过线粒体转移的方式对免疫细胞,特别是T细胞,产生深远影响。该研究揭示了这一机制的关键步骤:
转移后的代谢干扰:当癌细胞将携带mtDNA突变的线粒体转移到T细胞后,这些线粒体开始整合到T细胞的代谢网络中。然而,由于mtDNA突变导致线粒体功能异常,T细胞的能量代谢迅速被干扰。研究显示,这些线粒体的ATP生成能力显著降低,同时ROS的产生显著增加。这种代谢紊乱迫使T细胞过度依赖糖酵解,而放弃更高效的氧化磷酸化路径,从而削弱其持久的免疫功能。
功能性障碍与效应丧失:随着T细胞的代谢逐渐紊乱,其功能性逐步丧失。实验表明,接受癌细胞线粒体转移的T细胞在抗原识别和细胞毒性方面表现出显著下降。这些T细胞不仅无法有效杀伤癌细胞,还进入了早衰状态,进一步降低了抗肿瘤免疫的效果。
ROS的累积效应:高水平的ROS是癌细胞mtDNA突变线粒体的“标志”,而ROS的累积会直接损伤T细胞的DNA和蛋白质,触发细胞凋亡或衰老机制。此外,ROS还通过激活T细胞内的特定信号通路,抑制其分化为记忆T细胞,削弱了免疫系统的长期保护能力。
具体来看,通过对肿瘤患者的T细胞和健康个体的T细胞进行比较,研究发现,肿瘤患者的T细胞中携带mtDNA突变的线粒体比例显著升高,这些T细胞的ROS水平比正常T细胞高出2.5倍。此外,实验还显示,接受mtDNA突变线粒体的T细胞在氧化磷酸化酶活性和ATP生成方面下降了40%以上,而糖酵解相关的代谢酶活性则增加了近60%。
线粒体保护机制:癌细胞的秘密武器
逃避清除的谜题:转移线粒体的“伪装术”
通常情况下,细胞拥有一套精密的清除系统,能够通过线粒体自噬(mitophagy)及时处理受损或功能异常的线粒体,以维持细胞内环境的稳定。然而,癌细胞转移到T细胞的线粒体却成功逃避了这套清除机制,得以在T细胞中稳定存在。为什么这些突变的线粒体能够“免于追责”?
研究发现,癌细胞转移到T细胞的线粒体携带特定的保护分子,这些分子可以干扰T细胞线粒体自噬的正常过程。例如,癌细胞分泌的外泌体不仅携带突变的线粒体,还包含能够抑制自噬信号通路的蛋白分子。这种“伪装”策略使T细胞无法识别并清除这些异常线粒体,从而导致功能受损。
USP30:癌细胞的关键保护因子
该研究重点揭示了去泛素化酶USP30在这一过程中扮演的重要角色。USP30是一种位于线粒体外膜的去泛素化酶,通过移除泛素分子阻止线粒体被标记为自噬靶点。在癌细胞转移的线粒体中,USP30的高表达被认为是其逃避T细胞自噬清除的核心机制。
研究表明,USP30通过以下机制发挥作用:
抑制泛素标记:泛素化是细胞标记受损线粒体用于自噬降解的关键步骤。然而,USP30通过移除线粒体外膜上的泛素分子,使突变线粒体得以“逃脱”自噬系统的识别。
保护突变线粒体的稳定性:USP30不仅阻断了自噬的触发,还帮助转移的线粒体维持膜电位和嵴结构的完整性,从而延长了这些功能异常的线粒体在T细胞中的存活时间。
干扰免疫代谢:转移的突变线粒体通过USP30的保护机制长期存在,持续破坏T细胞的代谢平衡,使其丧失抗肿瘤活性。这种效应在携带mtDNA突变的肿瘤患者中尤为显著。
具体来看,在实验模型中,研究人员通过基因敲除技术抑制USP30的表达后,T细胞中异常线粒体的清除率显著提升,T细胞的功能恢复能力也得到明显改善。同时,肿瘤生长速率显著减缓,表明USP30在癌细胞免疫逃逸中的重要性。
此外,临床样本分析显示,高USP30表达与肿瘤患者对免疫检查点抑制剂(ICI)治疗的低反应性显著相关。这一发现进一步验证了USP30作为癌细胞免疫逃逸核心因子的科学意义。
免疫治疗的新困境与出路
癌细胞携带的mtDNA突变通过影响线粒体转移,削弱了浸润肿瘤的淋巴细胞(TILs)的代谢功能,进一步抑制了T细胞的抗肿瘤活性。这种代谢紊乱不仅使T细胞在肿瘤微环境中处于劣势,还通过诱导T细胞早衰和效应丧失,降低了ICI疗法对患者的临床疗效。
该研究分析了多种癌症类型中mtDNA突变的分布,并将其与患者对ICI治疗的反应进行比较。结果显示:在携带高频mtDNA突变的肿瘤患者中,ICI治疗的总体缓解率显著低于低突变频率患者。mtDNA突变不仅与T细胞功能损伤密切相关,还导致肿瘤微环境中免疫抑制分子的表达增加,如程序性死亡配体1(PD-L1)。
这些数据表明,mtDNA突变可能是影响ICI疗效的重要生物标志物,而其背后的机制则涉及癌细胞通过线粒体转移干扰T细胞功能的能力。
破解困境:基于线粒体转移的潜在治疗策略
面对mtDNA突变对ICI疗效的负面影响,研究人员正探索多种基于线粒体转移机制的新型治疗策略。这些创新方法为增强免疫治疗效果提供了新的希望。
USP30抑制剂:如上文所述,去泛素化酶USP30是线粒体转移过程中关键的保护分子。通过阻断USP30的功能,可以增强T细胞对癌细胞转移线粒体的自噬清除能力,从而恢复T细胞的正常代谢和功能。初步研究显示,USP30抑制剂在动物实验中显著提高了ICI疗法的效果,使得T细胞在肿瘤微环境中重新获得活性。
线粒体转移阻断剂:另一种策略是直接阻断癌细胞向T细胞转移线粒体的过程。例如,靶向干扰细胞间纳米管或外泌体的形成和功能,可以有效减少线粒体转移的发生。这些阻断剂的开发正在积极进行,早期数据表明其在限制肿瘤扩散和改善ICI疗效方面具有巨大潜力。
mtDNA突变特异性疗法:基于mtDNA突变的个体化治疗策略也是未来的重要方向。例如,通过基因编辑技术修复癌细胞的mtDNA突变,或设计靶向mtDNA突变的分子药物,可以从根本上降低mtDNA突变对免疫系统的负面影响。
通过揭示mtDNA突变对免疫治疗的影响,该研究为癌症治疗提供了全新的视角。这不仅帮助研究人员更深入地理解癌症的免疫逃逸机制,也为开发更精准、更有效的治疗策略铺平了道路。
未来,结合mtDNA突变分析的生物标志物筛查技术有望被广泛应用于临床,以预测患者对ICI疗法的反应。此外,基于线粒体转移机制的多靶点干预策略可能成为癌症治疗的新基石。这些努力最终将帮助更多患者从免疫治疗中受益。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


