《癌细胞》:肿瘤也练“铁布衫”!中山大学团队发现乳腺癌对曲妥珠单抗耐药的新机制
来源:奇点糕 2022-12-14 13:33
本研究首次发现了表达CD16的独特CAFs亚群,揭示了FcγR在促进乳腺癌靶向HER2治疗耐药中的作用及潜在机制,提出靶向CD16+CAF中VAV2的新型治疗方法,为改善乳腺癌当前治疗现状提供了新的治
单克隆抗体(mAb)已成为治疗各类恶性肿瘤的重要手段。
由Fcγ受体(FcγR)介导的免疫应答反应,是mAb发挥疗效的重要生物学基础之一[1]。
FcγR介导的免疫反应因不同的效应细胞类型而具有高度的多效性,例如,NK细胞等杀伤性细胞等可通过FcγR结合mAb的Fab段,介导抗体依赖的细胞介导的细胞毒性作用(ADCC);而巨噬细胞则可通过FcγR发挥抗体依赖的细胞介导的吞噬作用(ADCP),此外,FcγR还与DC细胞的抗原呈递功能相关[2]。
值得注意的是,目前关于肿瘤中FcγR相关效应反应的大多数研究都集中于免疫细胞[3]。其他细胞类型表达FcγR的状况,以及它们的功能和对mAb治疗效果的影响,目前仍知之甚少。
近日,由中山大学苏士成领衔的研究团队,在著名期刊Cancer Cell发表了一项重要研究成果[4]。
他们在人乳腺癌中发现一种表达III型Fcγ受体(CD16)的独特成纤维细胞亚群,在曲妥珠单抗刺激下,这群成纤维细胞可通过增强细胞外基质硬度,来阻碍药物递送,诱导肿瘤耐药。
更重要的是,他们还发现靶向VAV2可抑制该群细胞中Fcγ受体介导的促癌信号,为探索靶向CAFs的治疗方案提供了新的思路。

论文首页截图
为了了解乳腺癌组织中不同类型细胞FcγR的表达情况,研究人员首先通过流式细胞术检测了32例乳腺癌标本中FcγRs的表达,发现部分表达CD32b/c(FcγRIIb/IIc)和CD16(FcγRIII)的细胞竟然是CD45-非免疫细胞。
进一步分析发现,CD32b/c+CD45-细胞是肿瘤细胞,这与先前的研究一致[5]。令人意外的是,表达CD16的CD45-细胞是成纤维细胞,这引起了研究人员的注意。
为了进一步验证这一发现,研究人员分离了68名乳腺癌患者肿瘤样本中的CAFs。流式细胞术分析发现,近半数样本中可检测到CD16+CAFs,而且CD16+CAFs约占肿瘤CAFs总数的20.13%±3.38%。进一步分析发现,与之前的研究不同[6, 7],CD16+CAFs为一群αSMA+FAP-CD10-GPR77-的独特成纤维细胞亚群。
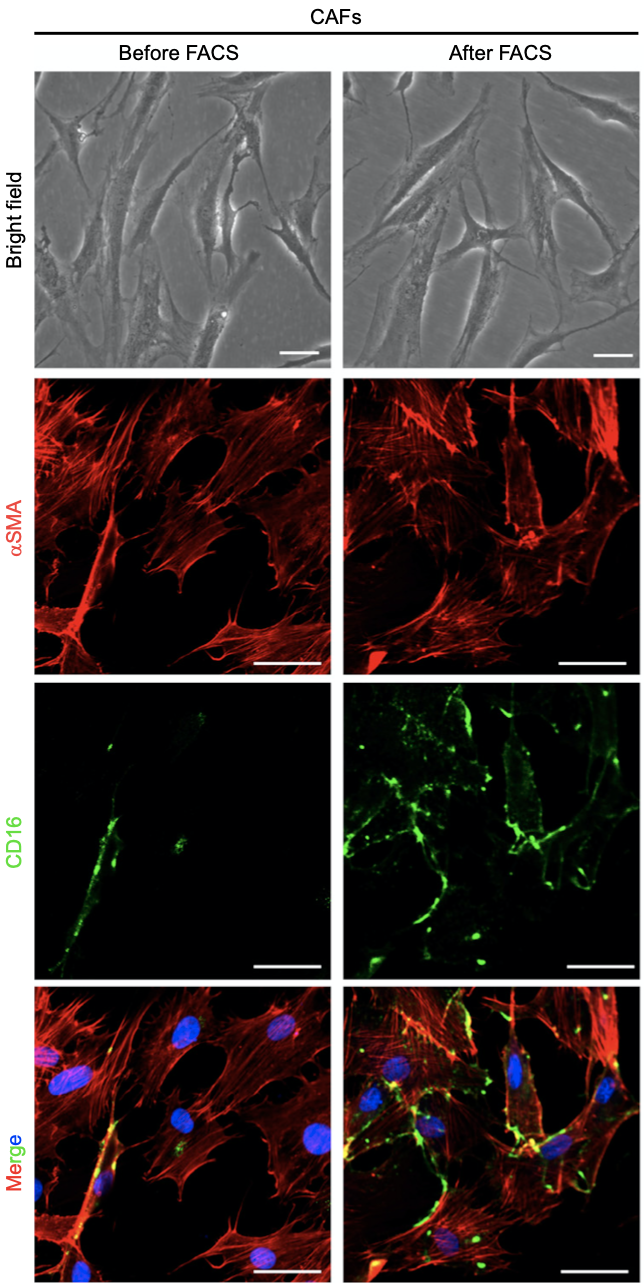
CD16+αSMA+细胞表现出典型的活化成纤维细胞形态
研究人员还比较了CD16+CAFs和乳腺癌中其他细胞类型上CD16的相对水平,发现CD16+CAFs的CD16表达水平低于NK细胞和骨髓细胞,但远高于T细胞和B细胞。
乳腺癌中CD16+CAF亚群的临床意义如何呢?研究人员分析了814例初治乳腺癌样本中的CD16和αSMA的免疫荧光染色结果,发现CD16+CAF的数量与HER2阳性乳腺癌亚型患者的不良预后显著相关,而对其他亚型患者预后的影响并不显著。
靶向HER2治疗是HER2阳性乳腺癌患者的重要治疗手段,研究人员分析了CD16+CAF与HER2阳性乳腺癌治疗反应的相关性,结果发现对曲妥珠单抗治疗耐药的患者肿瘤标本中的CD16+CAF浸润明显高于响应患者。
基于这些结果可以得出结论:CD16+CAF是影响HER2阳性乳腺癌患者对曲妥珠单抗耐药和长期生存的重要因素。
为进一步研究CD16+CAF在诱导曲妥珠单抗耐药中的作用,研究人员构建了患者来源的异种移植瘤(PDX)模型,发现高CD16+CAF浸润的PDX对曲妥珠单抗的反应率显著低于低CD16+CAF浸润的PDX。
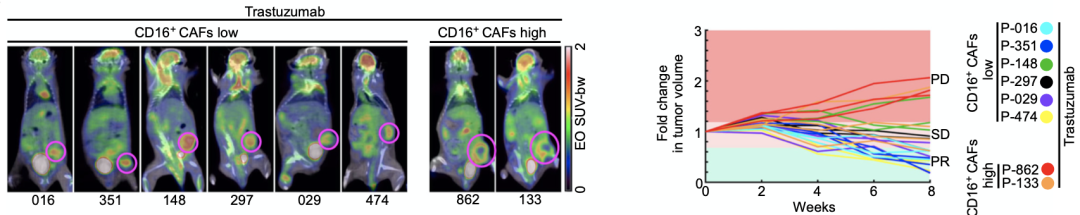
高CD16+CAF浸润的PDX对曲妥珠单抗的反应率低于低CD16+CAF浸润的PDX
随后,研究人员在曲妥珠单抗治疗的同时,使用了靶向CD16的特异性中和抗体。治疗数据显示,CD16阻断显著增强了曲妥珠单抗对CD16+CAF高浸润的PDX的疗效,而对CD16+CAF低浸润PDX则没有明显影响,这表明CD16+CAF在诱导曲妥珠单抗耐药过程中发挥重要作用。
为进一步验证上述结论,研究人员构建了肿瘤细胞与成纤维细胞共注射的小鼠模型,将CD16+CAF与CD16-CAFs分别与乳腺癌BT-474细胞共同注射到NOD SCID小鼠中,或在共注射之前用慢病毒shRNA载体沉默成纤维细胞中的CD16,发现CAF中CD16表达缺失后,肿瘤对曲妥珠单抗敏感性升高。这些证据证明成纤维细胞中的CD16是介导乳腺癌曲妥珠单抗耐药的重要因子。
接着,研究人员构建了CD16-FcRγ突变的CAFs,以阻断CD16介导的细胞内信号转导。通过与肿瘤细胞共注射,他们发现CD16-FcRγ突变的CAFs不能诱导曲妥珠单抗耐药,这表明抗HER2治疗疗效的降低依赖于CAFs中CD16介导的细胞内信号传导。
鉴于成纤维细胞在协调肿瘤纤维增生中发挥重要作用,研究人员基于原子力显微镜等技术,评估了对曲妥珠单抗治疗敏感或耐药的HER2阳性乳腺癌患者的肿瘤硬度,发现曲妥珠单抗耐药患者的肿瘤硬度更大。更重要的是,CD16+CAF的浸润数目与组织硬度显著正相关。
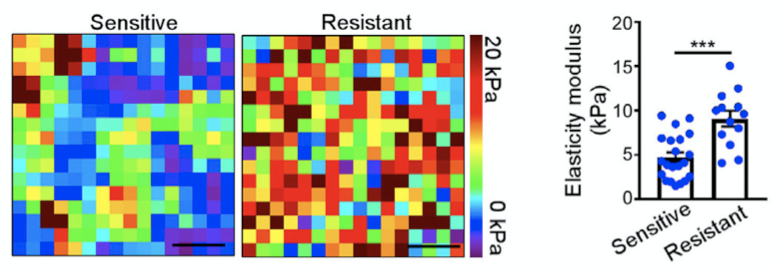
基于原子力显微镜评估乳腺癌患者的肿瘤硬度
研究人员测量了曲妥珠单抗治疗前后CD16+CAF和肿瘤细胞的接近程度,发现曲妥珠单抗治疗后CD16+CAF与肿瘤细胞之间的距离明显缩短,表明曲妥珠单抗治疗时结缔组织的增加与CD16+CAF有关。
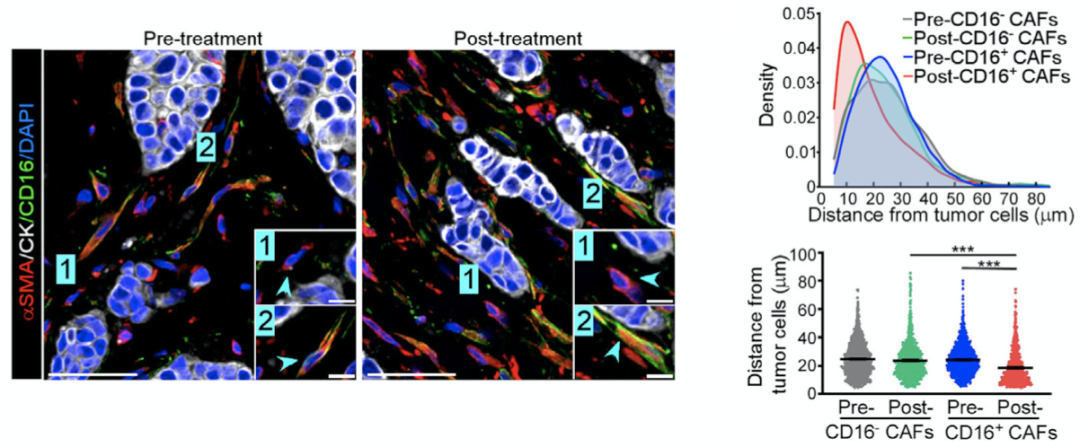
曲妥珠单抗治疗后,CD16+CAF与肿瘤细胞间的平均距离明显缩短
那么CD16+CAF如何诱导曲妥珠单抗耐药呢?通过PDX模型,研究人员发现CD16+CAF在曲妥珠单抗存在下可明显增强肿瘤结缔组织增生。
已有研究表明纤维增生引起血管压迫,导致药物输送受到抑制是引起治疗耐药的关键因素[8, 9]。应用3D荧光显微成像技术,研究人员发现CD16+CAF降低了荷瘤小鼠血管灌注和通透性,阻碍了肿瘤组织中曲妥珠单抗及其联合用药时化疗药物的递送。
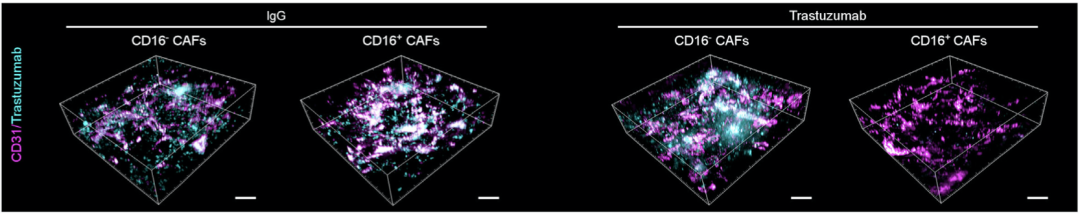
CD16+CAF阻碍肿瘤组织中曲妥珠单抗递送
进一步机制研究发现,曲妥珠单抗激活CD16+CAF介导的CD16/SYK/VAV2/RhoA/ROCK/MLC2/MRTF-A途径,诱导结缔增生。
此外,研究人员注意到该通路的关键因子VAV蛋白家族成员VAV2在CD16+CAF高度表达,那么VAV2能否成为乳腺癌靶向HER2的联合治疗新靶点呢。为了验证这一猜想,研究人员沉默了CD16+CAF中的VAV2,观察到曲妥珠单抗诱导的肌动蛋白聚合和胶原收缩受到明显抑制。
研究人员进一步探索了靶向VAV2对乳腺癌的治疗潜力,通过共注射模型和PDX模型实验发现CD16+CAF中的VAV2沉默逆转了肿瘤纤维增生,增强了肿瘤对曲妥珠单抗的敏感性。
值得关注的是,研究人员还发现VAV2对于成纤维细胞中CD16的功能是必不可少的,但沉默NK细胞以及巨噬细胞中的VAV2表达并不影响其ADCC或ADCP功能的发挥,这表明沉默VAV2特异性阻断了Fcγ受体介导的促癌信号,而不干扰免疫细胞Fcγ受体介导的肿瘤杀伤作用。因此靶向VAV2是提高曲妥珠单抗疗效的安全而有效的潜在联合治疗方式。
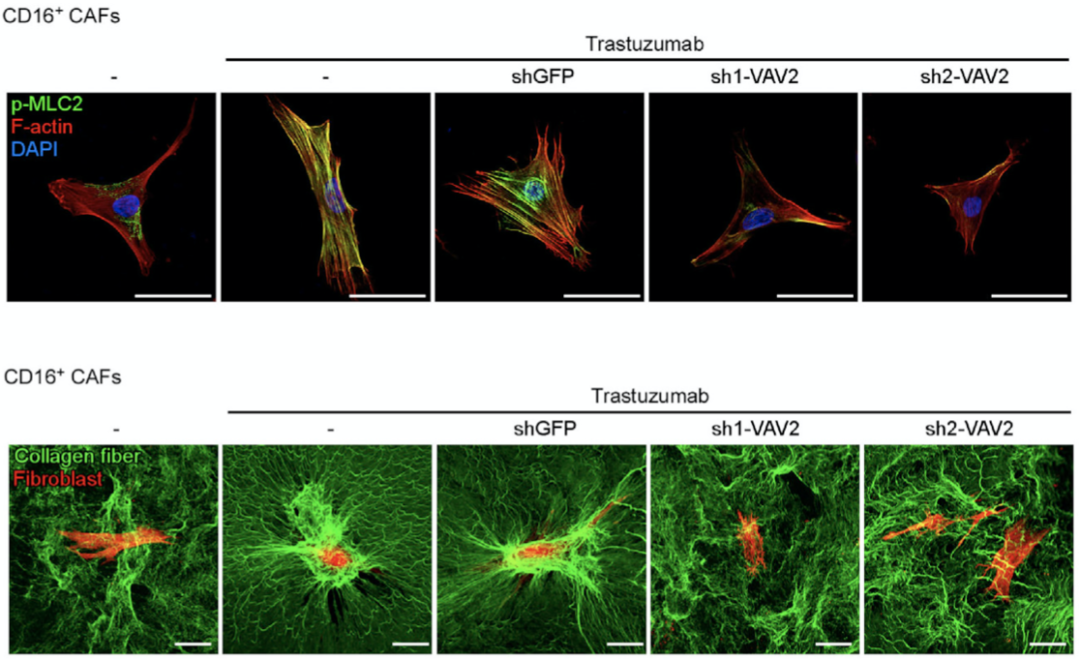
CD16+CAF中VAV2的沉默抑制肿瘤纤维增生
总的来说,本研究首次发现了表达CD16的独特CAFs亚群,揭示了FcγR在促进乳腺癌靶向HER2治疗耐药中的作用及潜在机制,提出靶向CD16+CAF中VAV2的新型治疗方法,为改善乳腺癌当前治疗现状提供了新的治疗靶点。
参考文献:
[1] Chau CH, Steeg PS,Figg WD. Antibody-drug conjugates for cancer[J]. Lancet, 2019, 394 (10200):793-804. DOI:10.1016/s0140-6736(19)31774-x.
[2] Bournazos S,Ravetch JV. Fcγ Receptor Function and the Design of Vaccination Strategies[J]. Immunity, 2017, 47 (2):224-233. DOI:10.1016/j.immuni.2017.07.009.
[3] Rosales C. Fcγ Receptor Heterogeneity in Leukocyte Functional Responses[J]. Front Immunol, 2017, 8:280. DOI:10.3389/fimmu.2017.00280.
[4] Liu X, Lu Y, Huang J, et al. CD16(+) fibroblasts foster a trastuzumab-refractory microenvironment that is reversed by VAV2 inhibition[J]. Cancer Cell, 2022, 40 (11):1341-1357.e1313. DOI:10.1016/j.ccell.2022.10.015.
[5] Cassard L, Cohen-Solal JF, Galinha A, et al. Modulation of tumor growth by inhibitory Fc(gamma) receptor expressed by human melanoma cells[J]. J Clin Invest, 2002, 110 (10):1549-1557. DOI:10.1172/jci15454.
[6] Costa A, Kieffer Y, Scholer-Dahirel A, et al. Fibroblast Heterogeneity and Immunosuppressive Environment in Human Breast Cancer[J]. Cancer Cell, 2018, 33 (3):463-479.e410. DOI:10.1016/j.ccell.2018.01.011.
[7] Su S, Chen J, Yao H, et al. CD10(+)GPR77(+) Cancer-Associated Fibroblasts Promote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness[J]. Cell, 2018, 172 (4):841-856.e816. DOI:10.1016/j.cell.2018.01.009.
[8] Martin JD, Seano G,Jain RK. Normalizing Function of Tumor Vessels: Progress, Opportunities, and Challenges[J]. Annu Rev Physiol, 2019, 81:505-534. DOI:10.1146/annurev-physiol-020518-114700.
[9] Mohammadi H,Sahai E. Mechanisms and impact of altered tumour mechanics[J]. Nat Cell Biol, 2018, 20 (7):766-774. DOI:10.1038/s41556-018-0131-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


