Cancer Discovery:上海交大瑞金医院卢敏团队建立p53靶向药物研究规范
来源:生物世界 2024-11-10 11:31
研究指出p53恢复剂研究中缺失的科学逻辑、长期以来对p53突变体的误解、p53恢复剂的研发障碍、p53恢复剂有效性的评估标准、p53恢复剂的临床试验规范、p53恢复剂的研发经验教训、p53的成药前景。
一半以上癌症驱动突变发生于抑癌蛋白,少部分则发生于癌蛋白。靶向抑癌蛋白需要史无前例地恢复(而非常规地抑制)蛋白功能,尚无成功先例。抑癌蛋白p53是生物医学历史上被研究最多的蛋白,医学领域对p53恢复剂的探索热情不亚于物理学领域对室温超导体的探索热情——已有至少71个团队在 Science、Nature 等期刊报道获得p53恢复剂,并进入超过23项临床试验,治疗了1000多位癌症患者。
但遗憾的是,绝大多数p53恢复剂在实验室都检测不到活性,在临床上迄今未能观察到任何具有统计学显著的患者获益。
卢敏早期揭示了癌症中p53功能丧失的新机制(Cell 2014,Cancer Cell 2013,Nat Rev Mol Cell Biol 2016)【1-3】,近年来设计p53功能恢复策略并揭示其结构学机制(Cancer Cell 2021)【4】,并获得迄今唯一有效的p53恢复剂ATO(Cancer Cell 2024)【5】,之后首次在人体内(First-in-human)实现p53突变体功能恢复(Sci Transl Med 2023)【6】。
2024年11月1日,上海交通大学医学院附属瑞金医院卢敏为独立通讯作者,宋花歆、肖淑君、吴嘉祺作为共同第一作者,在 Cancer Discovery 期刊发表了题为:Drugging p53: Barriers, Criteria, and Prospects 的综述论文【7】,提出了p53恢复剂的研究规范,指出p53恢复剂研究中缺失的科学逻辑、长期以来对p53突变体的误解、p53恢复剂的研发障碍、p53恢复剂有效性的评估标准、p53恢复剂的临床试验规范、p53恢复剂的研发经验教训、p53的成药前景。


抑癌蛋白迄今不可成药
在OncoKB数据库中收录的数百种明确的癌症驱动基因中,大约51%编码抑癌蛋白,24%编码癌蛋白。尽管目前已有大量癌蛋白已经成药,但抑癌蛋白仍不可成药(undruggable)。抑癌蛋白p53在全球约50%的癌症患者中发生突变,这一患者数量超过当前临床使用的所有约85个靶向抗癌小分子药物可适用患者的总和(共约10%),这使得p53成为历史上被研究最多的蛋白(基因),且大幅领先研究第二多的TNF。
在学术界,至少有71个团队在 Science、Nature、Cancer Cell、Nature Medicine 等期刊报道获得p53突变体靶向小分子,其中绝大部分是结合p53突变体并恢复其抑癌功能的小分子化合物(我们将这类小分子命名为恢复剂。注:激动剂是指将功能正常的“野生型蛋白”从静息状态“激动”到活跃状态的药物;相当于唤醒正常但处于睡眠状态的手机,以用于打电话。恢复剂是指将“突变型蛋白”从一个丧失功能的蛋白“恢复”成有功能的蛋白的药物;相当于修理好一个坏掉的手机,以用于打电话);在工业界,p53恢复剂催生了多家初创药企以及2家纳斯达克上市药企;在临床上,有7个p53恢复剂进入超过23项临床试验,被注射进入超过1000位癌症患者体内。综合以上学术界、工业界、临床试验的统计学数字,表明医学领域对p53恢复剂的狂热不亚于物理学领域对室温超导体的狂热。
遗憾的是,这些p53恢复剂往往检测不到p53功能恢复能力,迄今也未能观察到任何统计学显著的患者获益。难以获得p53恢复剂的科学挑战在于:用药物靶向抑癌蛋白需要史无前例地恢复(而非常规地抑制)蛋白功能。更具体地说,用小分子竞争性占据癌蛋白的配体结合口袋以抑制蛋白功能是成熟、具科学逻辑性、可以理解的靶向策略;但用小分子结合抑癌蛋白并恢复其功能的靶向策略缺乏科学逻辑,难以理解这个过程如何发生。试想,如果用小分子结合至抑癌蛋白的活性位点,那么结果应该只会是抑制(而非恢复)蛋白功能;如果用小分子结合至抑癌蛋白的非活性位点,那么这种结合又如何能实现蛋白功能恢复?
在该综述中,作者们以p53作为抑癌蛋白的一个典型例子,剖析靶向抑癌蛋白所面临的领域困境。他们没有复述现有的p53文献,因为已经有很多科学家和期刊为这些海量p53文献撰写综述,比如近几年大量Cell、Cancer Cell、Nature Reviews对p53领域的综述;而是重点讨论了7个从未被任何综述所涉及的主题:
p53恢复剂研究中缺失的科学逻辑;
对p53突变体的误解;
研发p53恢复剂的障碍;
p53恢复剂有效性的评估标准;
p53恢复剂的临床试验规范;
研发p53恢复剂的经验教训;
p53的成药前景。
主题一:唯一具科学逻辑的p53功能恢复策略(靶向蛋白折叠策略,TPF)
p53主要通过与DNA结合并转录激活其下游的靶基因来发挥抑癌功能。癌症中至少存在数千种不同的p53突变,这些突变通过各种不同的机制削弱p53与DNA的结合能力,从而削弱其抑癌功能(图A,蓝色框)。
某些突变正好发生于p53的DNA结合氨基酸(通常是带正电的精氨酸),导致这些突变体无法结合DNA,从而失去抑癌功能,这一类突变体被称为“DNA结合型突变体”。至今不存在(短期的将来应该也不会出现)可以理解的、针对这些突变体的功能恢复策略。作为一个重要的转录因子,p53进化出的DNA结合氨基酸可以与DNA的大沟和小沟在形状、电荷、朝向上完美匹配。很难想象一个小分子可以在形状、电荷、朝向上弥补因突变而缺失的精氨酸,此外还可以消除因突变而出现的新氨基酸所带来的负面影响。虽然已有研究报道某些化合物可以插入p53与DNA的结合面,但预期这些化合物只会削弱p53的DNA结合能力。p53 C277Y和C277W是功能完全丧失的突变体(具体功能丧失数据见www.rescuep53.net),正好证明了这一点(注:C277Y和C277W这两个突变在DNA结合氨基酸Cys277上引入大尺寸的氨基酸Y和W,因此可以较好地模拟这些插入p53和DNA结合面的化合物)。总之,DNA结合型突变体不太可能通过药物恢复功能,而只能通过基因工程手段进行功能恢复,例如通过基因突变重新引入可以结合DNA的精氨酸。
另一些突变则发生于维持p53三级结构的氨基酸,导致p53不能折叠出三级结构,进而不能结合DNA并失去功能,这类突变被称为“结构型突变体”。作为生物化学、结构生物学的一项基本原理(也是分子生物学教科书中的基本知识点),蛋白质的折叠由“氨基酸胶水”(例如疏水作用、氢键、二硫键等)驱动,这些“氨基酸胶水”将蛋白内部的2个或多个氨基酸胶联在一起(图B)。一个典型的例子是在核糖体中新合成蛋白的折叠过程,这亦是一项基本的生命过程。在癌症中,造成p53内部空腔化的突变(如F270L和V143A等突变在p53内部从大尺寸氨基酸变成小尺寸氨基酸)和扰乱L2-L3结构的突变(如R175H、R249S和C242S等使L2和L3相互作用丢失的突变)都导致p53中某些关键“氨基酸胶水”的丢失,进而导致p53从折叠状态转变为非折叠状态。反过来,当一个小分子结合到某个蛋白内部的口袋中时,它通常会提高蛋白的热稳定性(亦即结构稳定性)和折叠能力(亦即蛋白复性),因为它在口袋中创造了新的“氨基酸胶水”,将蛋白内部的多个氨基酸胶连到一起(图B)。这里,我们将促进蛋白折叠并恢复蛋白功能的靶向策略取名为靶向蛋白折叠策略(Targeted Protein Folding,TPF),类比于已经得到广泛应用的靶向癌蛋白的靶向蛋白抑制策略(Targeted Protein Inhibition,TPI)和新兴的靶向蛋白降解策略(Targeted Protein Degradation,TPD)。据我们所知,TPF是目前唯一具有科学逻辑的p53功能恢复策略,但该策略只适用于结构型p53突变体。
总之,任何靶向药物的研究都必须遵循科学逻辑,p53恢复剂研究也不例外,世界上并不应该存在可以不遵守科学逻辑的“神奇”的p53恢复剂。
主题二:4项对p53突变体的误解
关于p53突变体,有四个普遍存在的误解(图A,第一个灰色框),这些误解长期以来阻碍了领域发展。
第一个常见的误解是相信存在一种“神奇的”万能p53恢复剂,可以恢复所有不同p53突变体的抑癌功能。然而,基于p53突变体多样的失活机制(图A,蓝色框),很容易得出结论:任何一个p53恢复剂,只可能适用于失活机制与该恢复剂的工作机制一致的p53突变体。遗憾的是,当前许多实验室的基础研究仍然随意选择一个p53突变体进行研究。这种误解进一步导致临床医生在开展临床试验时,未对患者的p53突变类型进行分类,而是选择携带任意p53突变的患者进行临床试验。令人难以置信的是,领域内已经有几十个团队宣称获得了p53恢复剂,然而几十年过去了,这些团队仍没有鉴定其恢复剂可适用的p53突变体清单,而是泛泛地将之用于所有p53突变体的功能恢复。
第二个误解是认为可以通过传统的低温实验条件来评估结构型p53突变体的折叠情况。蛋白的折叠和不折叠状态是由其熔解温度(Tm)决定。在人体内,(在发生凝集沉淀之前)蛋白一直处于“折叠-不折叠”的动态转化过程中,当环境温度(Tambient)高于蛋白的Tm时,蛋白会趋向不折叠,反之则趋向折叠。野生型p53的Tm值约为42°C,因此在人体中(37°C)趋向折叠状态。而结构型突变体由于缺失若干“氨基酸胶水”,Tm值通常在20–37°C之间,因而在人体中处于非折叠状态并失去功能。需要注意的是,这些结构型突变体的Tm值仍远高于4°C,这意味着它们在传统4°C实验条件(注:为防止抗体失活,一般涉及抗体的实验都在4℃下开展)下仍保持折叠状态,不能真实反映他们在人体内的非折叠状态。因此,评估结构型p53突变体折叠状态的实验(如特异性识别折叠p53的PAb1620抗体的相关实验、特异性识别非折叠p53的PAb240抗体的相关实验)应在室温或更高温度下开展,以准确反映其在体内的非折叠状态。遗憾的是,目前几乎所有评估p53折叠状态的实验都只能依赖这些结构表位抗体且在4℃下开展。
第三个误解是认为“用小分子修饰p53表面的一个半胱氨酸可以促进p53折叠(亦即可以提高p53的Tm值)”。正如前文所述,蛋白的折叠主要由“氨基酸胶水”胶连蛋白内部的2个或多个氨基酸所驱动(图B)。这一基本概念得到了几乎所有约495个处于临床阶段和所有约85个获批的抗肿瘤靶向小分子的验证——这些靶向小分子结合靶蛋白内部的口袋,提供了“氨基酸胶水”,因此往往能提高靶蛋白的Tm值。遗憾的是,目前大量p53恢复剂都被认为是通过修饰p53表面的单个半胱氨酸来提高p53的Tm值(图B),然而,这完全不符合科学逻辑,世界上并没有如此“神奇”的促折叠机制。
第四个误解是认为结构型p53突变体会错误折叠(misfolded)。结构型p53突变体的Tm值低于人体体温37°C,因此,它们在人体内处于非折叠状态(unfolded),没有任何三级结构(图C,子图i)。在特定条件下,当Tm值重新大于环境温度时(例如通过小分子结合p53的口袋以提高p53的Tm值、通过基因工程方法在第二位点导入促结构稳定突变来提高p53的Tm值、降低环境温度),这些突变体会重新折叠,折叠后会出现两种情况:第一种是重新折叠成和野生型p53完全一样的三级结构(图C,子图ii),第二种是重新折叠成在整体上和野生型p53一致但在局部区域包含一个无序的L3环(图C,子图iii)。第二种情况往往是领域内认为p53突变体会misfold的原因。“Misfolded conformation”这个术语通常用于描述一种非野生型的、固定的、对应于某种特定新功能的构象,而结构型p53突变体在重新折叠以后,其L3环在第二种情况下既不固定、也不对应特定的新功能。因此,世界上根本不存在“错误折叠”的p53,这些所谓的“错误折叠”的p53实际上是“不折叠”的p53。所以领域内的研究目标应该定位于“使不折叠的p53蛋白重新折叠”,而非神奇地“纠正p53的错误折叠构象”。
主题三:4项研发p53恢复剂的障碍
在过去25年中,至少有71种p53恢复剂被报道,包括能够靶向各种p53突变体的广谱性恢复剂、特异性靶向Y220C单突变体的p53恢复剂。绝大多数已报道的p53恢复剂都是广谱性恢复剂,这里我们归纳了四个研发广谱性p53恢复剂的障碍(图 1A,粉色框)。在癌症靶向治疗的发展史上,尽管已有数百个靶向小分子药物进入临床阶段(约495个),并且有约85个获批临床使用,但极少有在未克服这四个障碍的情况下就可以宣称自己是靶向小分子。遗憾的是,在众多宣称的广谱性p53恢复剂中,除三氧化二砷(ATO)和其类似物以外,这四个障碍无一被克服。
第一个障碍是缺乏可以解释恢复剂工作机制(mechanism of action,MoA)的结构学模型——这是定义一个小分子是否为靶向小分子的关键。如上文所述,修饰暴露的单个半胱氨酸以恢复结构型p53突变体蛋白折叠的结构学模型不能解释其MoA。在几十个宣称的广谱性p53恢复剂中, ATO及其类似物因具有可以解释MoA的结构学模型而脱颖而出——通过将蛋白内部的Cys124、Cys135和Cys141氨基酸胶联在一起,从而促进结构型p53突变体折叠。因此,ATO倾向于恢复那些发生在“溶剂可及性低”的氨基酸上的突变,因为这些氨基酸位于蛋白内部所以更可能是负责维持p53三级结构的氨基酸,因而产生的突变体更可能是结构型突变体。
第二个障碍是缺乏对构效关系(structure-activity relationship,SAR)的理解。SAR对于药理学家验证上述结构学模型、挑选出最具潜力的候选化合物以开展昂贵的临床试验都至关重要。目前,绝大多数广谱性p53恢复剂都缺乏这些至关重要的SAR研究。ATO及其类似物是例外:在其结构学模型中,它们释放砷或锑原子与p53结合;在其SAR中,含有稳定的砷(或锑)-碳键的含砷(或锑)化合物不能释放砷(或锑)原子,而这些化合物不能恢复p53突变体的功能,因此ATO及其类似物不仅有SAR研究而且SAR结果与结构学机制相互兼容。
第三个障碍是缺乏对细胞中靶点特异性的研究——这是靶向小分子药物在人体内与其靶蛋白结合以调控其功能的基础。简单地说,靶点特异性主要取决于小分子与其结合口袋的互补性(图B)。然而,当前大多数广谱性p53恢复剂所谓的“MoA”是结合p53上暴露的某个巯基,这一过程仅仅涉及p53表面的一个半胱氨酸而不涉p53的任何口袋,因此这些恢复剂不可能具有p53结合特异性。确实,在p53的10个半胱氨酸中,这些恢复剂可以随意地结合到所有5个暴露的半胱氨酸(C124/C182/C229/C275/C277),此外它们还被证实可以结合各种各样的携带暴露巯基的细胞内蛋白,以及细胞质中超高浓度的含有巯基的谷胱甘肽(GSH)。相比之下,砷和锑原子同时结合p53内部三个空间距离靠近的巯基,因此在同基因型的细胞模型中展示出对p53这个靶点的较高特异性。这种特异性源于砷原子天生的化学性质:它需要同时结合三个巯基(砷原子几乎不结合双巯基或单巯基),而且这三个巯基之间的相互距离必须刚好合适(以便刚好能和砷原子形成3根共价键),而且这三个巯基还不能被Zinc占据。细胞中适合砷结合的蛋白口袋(即由空间距离靠近的三个巯基组成的口袋)的数量可能很有限。具我们所知,p53是唯一一个具有共结晶结构证据的砷原子结合蛋白。
第四个障碍是缺乏明确的可适用突变体的清单。这一点至关重要,因为只有明确知道哪些突变体可适用于被研究的靶向药物,临床试验才可能精准入组患者。如前文所述,即使是广谱性p53恢复剂,也不可能恢复所有p53突变体的功能。比如,通过靶向蛋白折叠策略(TPF)所研发的p53恢复剂,仅能恢复结构型p53突变体的功能。更复杂的是,即使在这些结构型突变体内部,TPF策略对不同突变体的恢复效率也存在差异(图 1C)。温度敏感(temperature sensitive,TS)亚型结构型突变体通常是最容易被TPF策略恢复功能的突变体。温敏型突变体的定义是:能够在环境温度(Tambient)降低时恢复功能的突变体。由于降低Tambient使“Tm > Tambient”成立,这将促进结构型p53突变体的重新折叠,因此可以推断TS型p53突变体是一类重新折叠以后能够组装出完整DNA结合面(从而恢复DNA结合能力和肿瘤抑制功能)的p53突变体(图1C,子图 ii)。典型的温敏型突变(如β-sandwich内的各种突变、V272M、R282W)通常发生在离DNA结合表面的区域,这使得在p53重新折叠过程中能够组装出完整的DNA结合面。
因此,任何能够促进“Tm > Tambient”这个不等式成立的策略,包括ATO及其类似物的药物学策略、在第二位点引入结构稳定性突变的遗传学策略、降低环境温度的策略,都倾向于恢复TS亚型结构型p53突变体的功能。反过来,非温敏型的结构型突变体是那些即使(被低温诱导)重新折叠也无法组装出完整DNA结合面的突变体(图1C,子图 iii),支持证据包括:典型的非温敏亚型或低温敏亚型的结构型突变体(如R249S、G245S、应该还包括R175H)通常发生于结合DNA的L2-L3 motif,这些突变体在重新折叠以后不能组装出完整的DNA结合面,解释了为什么它们在满足 “Tm > Tambient”蛋白整体重新折叠以后仍难以被TPF策略恢复功能。ATO(及其类似物)是唯一研究了可适用p53突变体的广谱性恢复剂——ATO在大规模生化实验、细胞实验、动物实验中,能够高效地复活33种突变体(往往是高温敏亚型的结构型突变体)、有效复活357种突变体(往往是低温敏亚型的结构型突变体)、不能复活410种突变体(往往是非结构型突变体,如DNA结合型突变体)。这一p53突变体的清单(具体见www.rescuep53.net),使得ATO临床试验能够根据患者是否携带这33种(或357种)可复活p53突变体来进行精准入组。
不幸的是,过去几十年来,已有大量的广谱p53恢复剂被报道出来,但发现者从不研究这些恢复剂到底适用于哪些p53突变体。在基础研究中,研究者随意选择p53突变体,结果往往选择R273H/C这个发生频率最高的DNA结合型突变(而如上文所述,这种突变体是不可能被恢复功能的);在临床试验中,所有广谱性p53恢复剂的临床试验(除ATO及其类似物的临床试验外)都不区分p53突变体地入组患者,尽管众所周知世界上并不存在“神奇”的可以恢复所有p53突变体功能的单一恢复剂。
主题四:4项p53恢复剂有效性的评估标准
最近,我们在10项常用的p53实验系统中,制备了上万个不同的生物学样品,头对头比较了所有可获取的(指可以商业购买、或化学结构已经报道因此能够自行合成;比如PC14586就属于不可获取的恢复剂)的p53恢复剂。遗憾的是,我们发现除了ATO及其类似物外,所有p53恢复剂在所有10个实验系统中均检测不到任何p53功能恢复效果。因此,领域内亟需可靠且简便的标准来评估现有(以及将来出现)的p53恢复剂的有效性。在靶向治疗领域,用于评估新发现的靶向小分子的核心标准包括:具有可以解释MoA的结构学模型、具有符合结构模型的构效关系SAR。但并不是所有细胞生物学实验室都具有这两项技术,为此我们提出了4项普通细胞生物学实验室都可以轻易测试的评估标准(图A,第二个灰色框)。
第一项标准是采用确认有效的、敏感的p53活性分析实验系统,比如p53野生型样品的信号强度应是p53缺失和p53突变型样品的几百倍,如荧光素酶报告基因检测系统(luciferase reporter assay这是分析转录因子转录活性的经典assay)、p53结构表位抗体PAb1620的免疫共沉淀实验(Co-IP);PAb1620只识别折叠状态下的p53)。2015年决定投入p53恢复剂研究工作前,我花费了一整年时间,专门测试了所有已报道p53活性实验系统、所有p53恢复剂,发现有两个值得领域内注意的地方:1)领域内广泛使用PAb1620抗体免疫荧光assay来检测折叠状态下的p53,但我们发现这个assay无法区分野生型p53、p53缺失和结构型p53突变样品,这可能是由于在细胞固定过程中折叠的p53不可避免地发生变性,导致不能被PAb1620抗体识别。2)温敏亚型的结构型突变体如 R282W和V272M即使已经完全重新折叠(根据其完全恢复的转录活性、高于37℃的Tm值推断),也不能被PAb1620抗体高效识别,这可能是由于p53的DNA结合域的拓扑结构效应所致。纵观文献中已经报道的各种p53恢复剂对p53转录活性和蛋白折叠的实验结果,发现文献中的恢复剂往往只能将p53突变体的转录活性或蛋白折叠提高1-2倍(注:往往需要提高上百、几百倍的提高,才可以达到野生型p53的水平;此外,很多实验系统的误差就有1-2倍),而ATO则往往可提高几十倍甚至几百倍的p53转录活性和蛋白折叠。
第二项标准是需加入野生型p53作为对照,这一简单的对照样品几十年来常常被忽视。加入这个对照样品有助于评估恢复剂离完全恢复p53功能还有多远。比如,尽管ATO上百倍地促进p53-R175H这一低温敏亚型结构型突变体的蛋白折叠,实现了蛋白折叠的完全恢复;但它仅仅3-4倍地提高p53-R175H的转录活性,远远不足以实现转录活性的完全恢复。
第三项标准是需加入一组功能恢复潜力明确的p53突变体作为内部对照。结构学机制以及大规模实验都表明,靶向蛋白折叠TPF策略对不同p53突变体的恢复效率是由突变体固有的突变特性预先决定的。TPF策略曾有三次被大规模用于恢复上百种不同p53突变体功能的测试,包括低温下培养细胞、ATO处理、PAT处理,实验结果都一致性表明各个p53突变体的恢复潜力的排名是固定的:高温敏亚型结构型突变体(如V272M/R282W)> 非/低温敏亚型结构型突变体(如R175H/G245S/R249S)> 非结构型突变体(如R273H/R248Q)(图C)。因此,如果现有的(以及将来的)某个p53恢复剂被报道可以恢复所有p53突变体的功能、或者恢复不同p53突变体的效率排名和上述不一致,那么它很可能并不直接靶向p53突变体,而是由p53突变引起的某些共同事件间接导致,比如p21下调或细胞氧化应激能力变化。
第四项标准是评估恢复剂对p53靶基因上调能力的时候,必须评估足够多的p53靶基因(理想情况是评估所有p53靶基因,如RNA-seq),而非只评估或只展示少数几个靶基因。在p53-null的细胞系中导入野生型p53,RNA-seq结果表明p53的靶基因会被整体上调(亦即大多数而非仅仅一部分p53靶基因被上调),并且是特异性上调(亦即p53靶基因相比基因组中的其余基因被特异性上调)。因此,有效的p53恢复剂应该模拟野生型p53,(和ATO一样)不仅整体地、还特异性地上调p53靶基因。很多p53靶基因是压力应激基因,他们可以在不依赖p53的情况下被化合物的细胞毒性所诱导上调。因此,以往文献中往往仅展示少数几个p53靶基因的上调,而不展示其余p53靶基因的表达(亦即没有确认p53靶基因是否属于整体上调)或基因组其余基因的表达(亦即没有确认p53靶基因属于否特异性上调),这不足以判断该恢复剂是否真能恢复p53的转录活性。
据我们所知,ATO及其类似物是唯一同时满足以上4项评估标准的p53恢复剂,而其余所有已报道的p53恢复剂则不能满足以上任何一项标准。因此,最简单的判断一个新发现p53恢复剂有效性的方法是加入阳性对照和阴性对照——ATO分别用于温敏亚型结构型突变体V272M和DNA结合型突变体R273H的功能恢复。
主题五:4项p53恢复剂的临床试验规范
自2009年以来,p53恢复剂已经进入了超过20项临床试验,涉及逾1000名患者,但迄今为止尚未发现任何统计学显著的患者获益。我们对所有大约85种已批准的靶向抗癌小分子进行逐个分析,总结出将实验室发现的靶向小分子推进至临床试验的4项研究规范:首先,需要具有可以解释MoA的结构学模型以明确其是一个靶向小分子;其次,SAR与提出的结构学模型需相互兼容以确定结构学模型的正确性;第三,具备细胞内靶点特异性以确保其进入人体细胞后能结合靶蛋白;最后,需有明确的可适用突变体的清单以便进行精准患者入组。这4项临床规范在各种获批的靶向药物(都是癌蛋白抑制剂)、甚至野生型p53功能强化剂(如处于临床阶段的MDM2抑制剂)的临床转化中都得到严格遵守。然而,除ATO及其类似物以外,所有进入临床试验的p53恢复剂都未遵守任何一项以上规范(图A,第三灰色框)。
此外,TP53是基因组中的一个特殊基因,它高频突变于几乎所有癌症类型,因此,p53恢复剂的临床试验还需考虑癌症类型。血液系统恶性肿瘤中TP53突变往往是一个关键的、甚至是唯一的癌症驱动突变——该突变与患者预后不良高度相关、复发患者TP53突变频率往往大幅升高、与TP53突变共发生的驱动突变较少——因此血液系统肿瘤是理想的p53恢复剂临床试验癌种。有趣的是,首次在人体内(First-in-human)实现p53突变体功能恢复(即上述提及的p53靶基因整体、特异性上调)就是利用ATO在血液系统肿瘤患者中取得的,这也是靶向治疗领域首次用小分子药物实现蛋白功能恢复,有望开启基于“蛋白功能恢复”而非“蛋白功能抑制”的疾病治疗模式。
主题六:研发p53恢复剂的经验教训
p53恢复剂并不“神秘”,有效的p53恢复剂必然遵循上文所述的制药常识和科学逻辑。我们总结出以下经验教训:在药物筛选阶段,需选择有功能恢复潜力的p53突变体(如结构型突变体),并采用具有科学逻辑的功能恢复策略(如TPF策略);在临床试验阶段,需选择合适的p53恢复剂(即满足上述4项有效评估标准和4项临床试验规范的恢复剂),并招募最可能有临床疗效的患者(如携带温敏亚型的结构型p53突变体的患者)。遗憾的是,据我们所知,目前仅有ATO(和其类似物)满足上述4项有效性评估标准和4项临床试验规范,其余所有几十个广谱性p53恢复剂均不能满足上述任何一条有效性评估标准,也不能满足上述任何一条临床试验规范。
主题七:p53靶向药物的前景
目前关于广谱性p53恢复剂有效性的报道很不一致,因此当前领域的一个重要任务应该是利用上述4项简单可靠的评估标准来评估现有(和未来)p53恢复剂的有效性,并选择符合上述4项临床规范的恢复剂进行临床试验。尽管ATO符合所有这些评估标准和临床规范,但作为一种已获批的老药,其商业价值有限。因此,需要科学家、临床医生、制药公司之间更紧密的合作,以验证其在TP53突变癌症患者(尤其是血液系统肿瘤患者)中的疗效。
第二个任务是在p53上鉴定新的小分子结合口袋(见图A,黄色框)。在癌症靶向治疗领域,蛋白的可成药性(druggability)在很大程度上取决于该蛋白是否含有深、窄、疏水的口袋,因为传统上只有这种口袋才能让小分子紧密结合。这一原则同样适用于p53。p53-Y220C上的Cys220口袋的发现,在过去几十年中极大地促进了众多Y220C单突变体特异性恢复剂的研究;然而,Cys220口袋是Y220C突变体特有的,而癌症相关的p53突变体有超过1000种。2021年我们团队发现的砷结合口袋(ABP)在几乎所有p53突变体中都存在,但由于该口袋空间较小,开发靶向ABP口袋的新型p53恢复剂具有较高挑战,一个例子是我们最近设计并进入工业界的肿瘤靶向性葡萄糖砷AcGlcAs,但该化合物在本质上也通过释放一个砷原子发挥功能。因此,领域中的第二个任务是在p53中鉴定更多的小分子结合口袋,无论是变构口袋抑或是被掩埋因而难以被发现的口袋。逐个分析所有约85个已获批靶向抗癌小分子药物的结合口袋,我们发现这些口袋绝大多数都是蛋白质进化出来结合某个内源性配体的位点,例如大量已成药激酶中的ATP结合口袋、BCL-2上的BH3结合表面、EZH2中的S-腺苷-L-甲硫氨酸结合口袋、SMO中的胆固醇转运通道、XPO1中的核输出信号NES结合凹槽。在p53上鉴定小分子结合口袋极具挑战性,因为生物体很少进化出不用于结合内源性配体但又可成药的口袋(亦即可供小分子紧密结合的深、窄、疏水口袋)。但这并非不可能成功,一个先例是KRAS中的SII-P口袋的发现,它使科学家能够在短短8年内将KRAS-G12C抑制剂从实验室发现推进到临床获批。
我们相信,本文提出的p53恢复剂研究规范,所涉及的7个主题(科学逻辑、领域误区、研发障碍、有效性评估标准、临床试验规范、经验教训、领域前景)可广泛适用于成药各种抑癌蛋白——癌症中最广泛存在但迄今无一成药的治疗靶点。
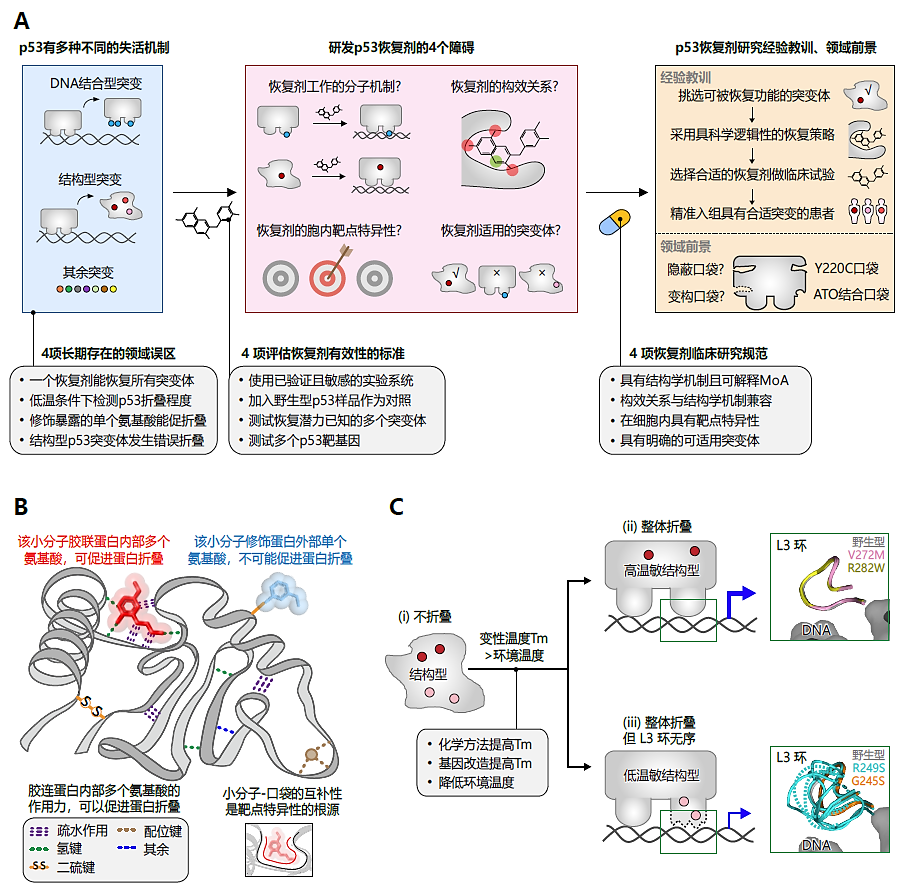
A)p53突变导致蛋白失去功能的多种机制(蓝色框)、研发p53恢复剂面临的4个障碍(粉色框),p53恢复剂研究的经验教训和成药(黄色框)。下方灰色框依次列出4项领域内误区、恢复剂的有效性评估标准、将恢复剂推进至临床试验的规范。(B)胶连蛋白内部的多个氨基酸的作用力,促进了蛋白折叠。这些作用力包括自发生成的作用力如疏水相互作用、氢键、二硫键等等,也包括小分子与口袋结合时导入的作用力。(C)p53靶向折叠策略TPF对不同结构型p53突变体具有不同的功能恢复效率的机制。在人体内,结构型p53突变体的Tm小于环境温度环境温度(37℃),因此处于非折叠状态(图i)。当使用图示的三种TPF策略实现“Tm大于环境温度Tambient”时,结构型突变体会重新折叠,要么重新折叠成和野生型完全一样的结构(子图 ii),要么还额外具有一个无序的L3环(子图 iii)。在子图ii中,高温敏型突变如β-sandwich突变、V272M、R282W因为远离负责结合DNA的L3环,使得这些突变体在重新折叠时能重新组装出野生型的L3 ,从而可以被TPF高效恢复功能;在子图iii中,非/低温敏型突变如G245S和R249S位于L3环并破坏了L3环,导致这些突变体在整体重新折叠后组装出无序的L3环,从而不能被高效恢复功能。
参考文献:
1. Lu, M., M.R. Muers, and X. Lu, Introducing STRaNDs: shuttling transcriptional regulators that are non-DNA binding. Nat Rev Mol Cell Biol, 2016. 17(8): p. 523-32.
2. Lu, M., et al., A code for RanGDP binding in ankyrin repeats defines a nuclear import pathway. Cell, 2014. 157(5): p. 1130-45.
3. Lu, M., et al., Restoring p53 function in human melanoma cells by inhibiting MDM2 and cyclin B1/CDK1-phosphorylated nuclear iASPP. Cancer Cell, 2013. 23(5): p. 618-33.
4. Chen, S., et al., Arsenic Trioxide Rescues Structural p53 Mutations through a Cryptic Allosteric Site. Cancer Cell, 2021. 39(2): p. 225-239 e8.
5. Xiao, S., et al., Characterization of the generic mutant p53-rescue compounds in a broad range of assays. Cancer Cell, 2024. 42(3): p. 325-327.
6. Song, H., et al., Diverse rescue potencies of p53 mutations to ATO are predetermined by intrinsic mutational properties. Sci Transl Med, 2023. 15(690): p. eabn9155.
7. Song, H., et al., Drugging tumor suppressor p53: barriers, criteria, and prospects. Cancer Discovery, 2024. 14(11).
8. Martinez-Jimenez, F., et al., A compendium of mutational cancer driver genes. Nat Rev Cancer, 2020. 20(10): p. 555-572.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


