Journal for ImmunoTherapy of Cancer:使用基因优化疫苗进行HPV-16 E6/E7 DNA疫苗接种可在普通外阴上皮内瘤变(uVIN)患者中引发临床和免疫反应:一项I/II期临床试验
来源:生物谷 2021-08-27 22:02
普通外阴上皮内瘤变(uVIN),也称为外阴高级鳞状上皮内病变,是一种外阴癌前慢性皮肤病,与高危型人乳头瘤病毒(HPV)的持续感染有关,主要是16型HPV。
普通外阴上皮内瘤变(uVIN),也称为外阴高级鳞状上皮内病变,是一种外阴癌前慢性皮肤病,与高危型人乳头瘤病毒(HPV)的持续感染有关,主要是16型HPV。感染高危基因型HPV会导致致癌HPV蛋白E6和E7的表达,E6和E7共同推动细胞永生化并在肿瘤进展过程中维持转化表型,E6和E7癌蛋白在转化细胞中持续表达,因此使转化细胞能够呈递E6和E7表位,并为T细胞识别。持续性uVIN患者通常具有功能失调的HPV16特异性T细胞反应,表明诱导或增强功能性HPV16特异性T细胞反应的免疫刺激疗法可能会带来临床益处。
图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
由于皮下注射基于肽的治疗性HPV疫苗的佐剂会导致严重的不良事件,因此研究者专注于改进疫苗的给药途径和优化疫苗的免疫原性,开发了一种可通过DNA疫苗接种的新型DNA疫苗,由于同时靶向E6和E7对HPV感染控制具有协同作用,两种致癌基因都以这种新形式被靶向。该研究旨在通过诱导CD4+来增加对E6和E7的免疫原性辅助T细胞,包括增强内质网靶向和保留的信号,并进行了一项I/II期临床试验,评估了uVIN患者中这种HPV-16 E6/E7 DNA疫苗接种的毒性、临床反应和免疫原性。
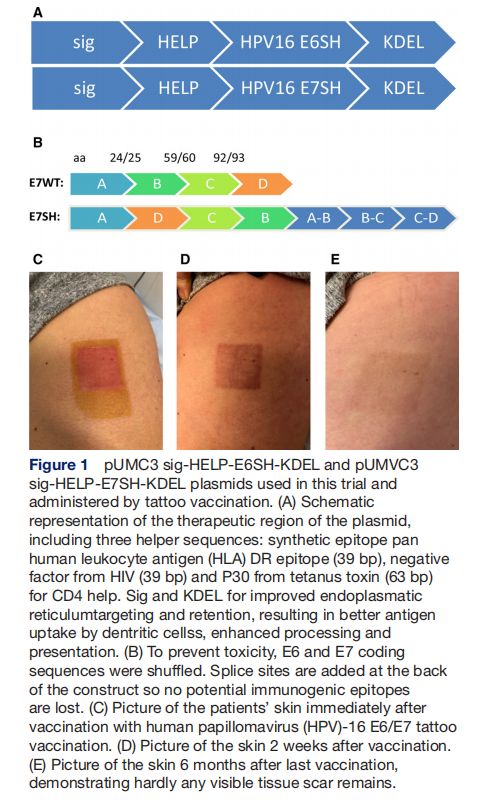
pUMC3 sig-HELP-E6SH-KDEL和pUMVC3 sig-HELP-E7SH-KDEL质粒通过疫苗接种 图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
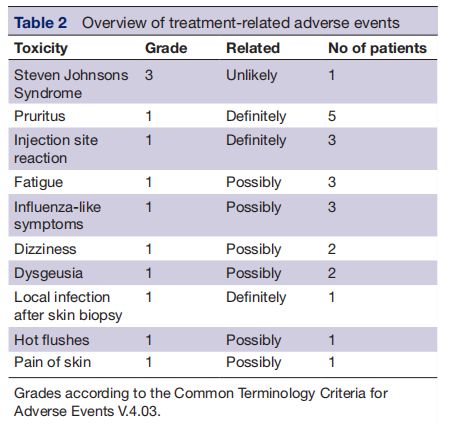
治疗相关不良事件的概述 图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
HPV-16 E6/E7 DNA疫苗包含sig-HELP-E6SH-KDEL和sig-HELP-E7SH-KDEL,它们分别是含有4814和5240个碱基对的质粒DNA构建体。在这个质粒中,巨细胞病毒启动子驱动E6SH和E7SH的连续表达,为了防止毒性并防止E6和E7的转化特性,编码序列被重新排列(“改组”),并且为了防止丢失潜在的免疫原性表位,在编码序列被切割的位置侧翼的序列被添加到编码区的3'端。有13名患者接受了所有四次疫苗接种,一名患者由于不良反应仅接受了两次疫苗接种;必须停止接种的患者(患者#12)在第二次接种后2周被诊断(通过皮疹活检)患有3级Stevens-Johnson综合征,因此该事件被报告为疑似意外严重不良反应(SUSAR),该患者从SUSAR中完全康复,在最后一次接种疫苗后的4个月内,所有皮肤损伤都消失了;其他患者没有高于1级的治疗相关不良事件。接种疫苗后注射部位的瘙痒是最常见的不良事件(36%)。
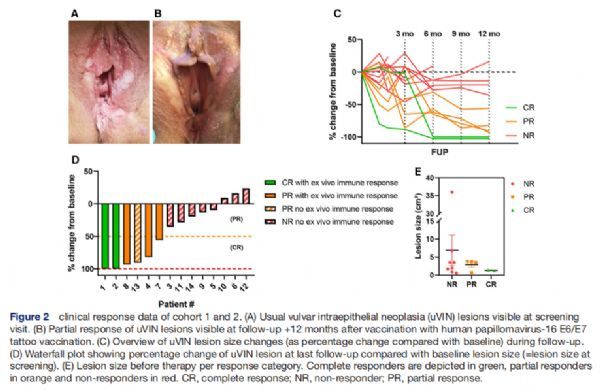
队列1和2的临床反应数据 图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
队列1中包括了5名患者,其中两名患者观察到完全响应(CR),1名患者观察到部分响应(PR),在随访期间(最后一次接种疫苗后12个月)观察到CR后,uVIN病变没有复发;患者#3未表现出临床反应,并在接种疫苗2年后接受激光蒸发治疗;患者#5没有表现出反应,并在最后一次接种疫苗后3个月开始接受咪喹莫特治疗。在队列2包括9名患者,其中3名患者在随访期间表现出持久的PR,3个月随访时的外阴活检显示所有接种疫苗的患者都有uVIN,这与在接种疫苗后6个月首次观察到CR的临床观察结果相关。有6名患者未表现出临床反应,1名患者(患者#11)在随访6个月后被诊断出患有微浸润性外阴癌,并进行了局部切除;患者#10接受了激光治疗;患者#12在随访84天后接受了激光切除术;患者#14没有表现出任何反应。
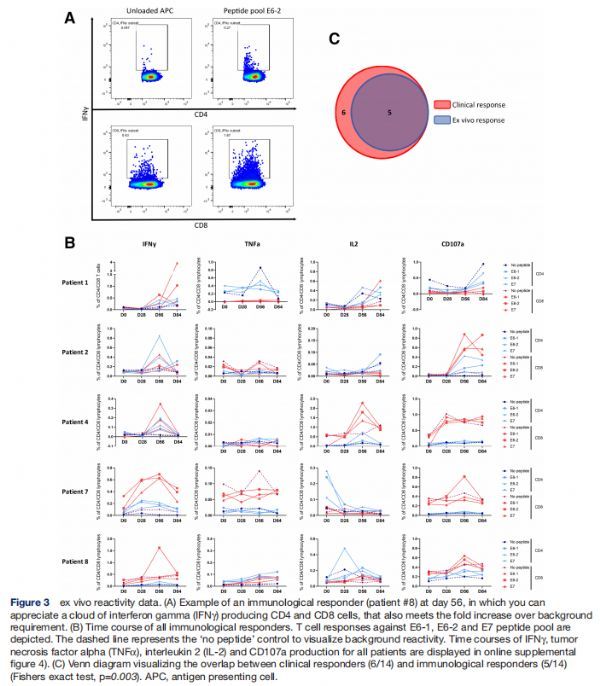
离体反应性数据 图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
用于T细胞表型表征的相同外周血单个核细胞(PBMC)也用于监测抗HPV16 E6和E7癌蛋白的全身免疫反应,如果一种或多种检测分子(IFNγ、TNFα、IL-2和CD107a) CD4+和/或CD8+T细胞阳性的百分比大于0.1%,且至少是背景值的两倍,则认为患者是免疫应答者。为了说明离体免疫反应,该研究在存在或不存在来自免疫应答者(患者#8)的载肽抗原呈递细胞(APC)刺激的情况下,CD4+和CD8+T细胞中IFNγ的表达。血液中免疫反应的峰值主要在第56天检测到,该研究中治疗的14名患者,有5名表现出离体免疫应答(36%免疫应答率),其中四种免疫反应在基线时未检测到,一种反应在疫苗接种后显着增加(患者#7 IFNγ)。在反应中测量的效应分子因患者而异,但IFNγ是主要效应分子(4/5),而CD4+和CD8+T细胞对所有肽库的反应性。
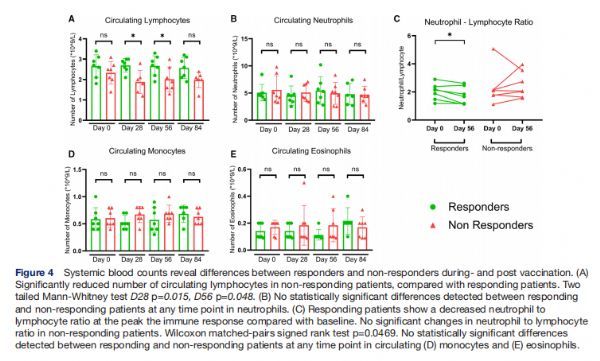
全身血细胞计数揭示了疫苗接种期间和之后的反应者和非反应者之间的差异 图片来源:http://dx.doi.org/10.1136/jitc-2021-002547
在与PBMC分离相匹配的时间点建立常规血细胞计数用于离体反应性测定。在基线时,在有反应和无反应的患者之间没有发现循环淋巴细胞、中性粒细胞、单核细胞和嗜酸性粒细胞数量的统计学显着差异,在第28天的疫苗接种期间以及第56天的反应高峰期,反应患者的淋巴细胞计数显著高于无反应患者;在有反应的患者中,与基线相比,全身中性粒细胞与淋巴细胞的比率在反应高峰时降低,而在无反应患者中未发现中性粒细胞与淋巴细胞比率随时间发生显着变化;与基线水平相比,响应者和NR的循环中性粒细胞、单核细胞和嗜酸性粒细胞的数量保持相似,并且没有改变。
该研究表明,HPV-16 E6/E7 DNA疫苗接种治疗HPV16阳性uVIN是一种安全且免疫有效的策略,并且在六分之五的临床反应患者中,可以在血液样本中检测到E6/E7特异性CD4+和CD8+ T细胞反应性,而在没有临床反应的患者中没有观察到这种反应。因此,HPV-16 E6/E7 DNA疫苗可能是uVIN患者具有临床意义的治疗策略。(生物谷 bioon)
参考文献
Noor Alida Maria Bakker et al. HPV-16 E6/E7 DNA tattoo vaccination using genetically optimized vaccines elicit clinical and immunological responses in patients with usual vulvar intraepithelial neoplasia (uVIN): a phase I/II clinical trial. Journal for ImmunoTherapy of Cancer (2021 Aug 02) doi:http://dx.doi.org/10.1136/jitc-2021-002547
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。